
【题目】铜及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_____(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)基态Cu原子中,核外电子占据的最高能层符号是_____,其核外电子排布式中未成对电子数为______个,Cu与Ag均属于IB族,熔点:Cu____Ag(填“>”或“<”)。
(3)[Cu(NH3)4]SO4中阴离子的立体构型是_________;中心原子的轨道杂化类型为__________,[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为________________。
(4)用Cu作催化剂可以氧化乙醇生成乙醛,乙醛中σ键和π键的比值为___________。
(5)碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
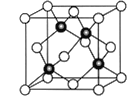
(6)Cu与Cl形成某种化合物的晶胞如图所示,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为__________(用含ρ、a的代数式表示)。
【答案】 bd N 1 > 正四面体 sp3 配位键 6:1 共价 398/(ρa3)mol-1
【解析】(1)铜或铜盐的焰色反应为绿色。焰色反应时,电子由较高能级跃迁到较低能级时,以光的形式释放能量,故a错误,b正确;焰色反应的光谱属于发射光谱,故c错误,d正确;故选bd;
(2)铜为第4周期元素,基态Cu原子中,核外电子占据的最高能层符号是N,其核外电子排布式为[Ar]3d104s1,其中未成对电子数为1个,Cu与Ag均属于IB族,铜原子半径小于银原子,铜原子对自由电子的吸引力大于银,金属键强于银,熔点高于Ag,故答案为:N ;1; >;
(3)[Cu(NH3)4]SO4中阴离子为SO42-,S原子与周围的4个O原子连接,采用sp3杂化,立体构型为正四面体;[Cu(NH3)4]SO4中Cu2+与NH3之间形成的化学键称为配位键,故答案为:正四面体;sp3;配位键;
(4)乙醛的结构式为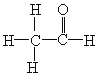 ,其中σ键和π键的比值为6:1,故答案为:6:1;
,其中σ键和π键的比值为6:1,故答案为:6:1;
(5)CuI中2种元素的电负性数值之差=0.6<1.7,属共价化合物,故答案为:共价;
(6)根据晶胞结构,Cu与Cl的个数分别为4,8×![]() +6×
+6×![]() =4,化学式为CuCl,则晶体的密度ρg·cm-3=
=4,化学式为CuCl,则晶体的密度ρg·cm-3=![]() ,解得NA=
,解得NA=![]() mol-1,故答案为:
mol-1,故答案为:![]() mol-1。
mol-1。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(1)18.6g Na2X含有0.6mol Na+,则X的相对原子质量为_______,该物质的化学式为________。
(2)与0.2mol H2含有相同电子数目的氦气分子的物质的量为__________。
(3)标准状况下,1.6 g某气态氧化物RO2体积为0.56 L,该气体的物质的量为________mol,RO2的相对分子质量为__________。
(4)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75 g/L,该混合气体的平均摩尔质量为__________,该气体对氢气的相对密度为__________,NH3的体积分数为__________。
(5)若a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(6)相同条件下,H2和O2的体积比为m∶n和质量比为m∶n的混合气体,其平均相对分子质量分别是_______________和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为②①③__________________⑦④。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、__________________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。
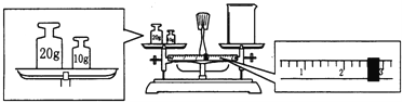
烧杯的实际质量为________g,要完成本实验该同学应称出________g NaOH。
(3)使用容量瓶前必须进行的一步操作是_________________。
(4)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是___________。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却至室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复倒转摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是ΔH1=-285.8kJ/mol、ΔH2=-1411.0kJ/mol和ΔH3=-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A. -44.2kJ/mol B. +44.2kJ/mol C. -330kJ/mol D. +330kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 22.4 L(标准状况)NH3含有的质子数为18NA
C. 常温常压下,16 g O2和O3混合物中含氧原子数目为NA
D. 密闭容器中,2 mol SO2和1 mol O2充分反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关苯分子中的化学键的描述正确的是 ( )
A. 每个碳原子的sp2杂化轨道中的一个形成大π键
B. 每个碳原子的未参加杂化的2p轨道形成大π键
C. 碳原子的三个sp2杂化轨道只形成两个σ键
D. 碳原子的未参加杂化的2p轨道形成σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2+O22SO3 , 在某密闭容器中达到化学平衡状态后,再往此容器中通入18O2 , 较长时间后,下列有关说法中正确的是( )
A.18O原子只存在氧气中
B.18O原子只存在三氧化硫中
C.18O一定不存在二氧化硫中
D.氧气中,二氧化硫中,三氧化硫中都可能存在18O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com