
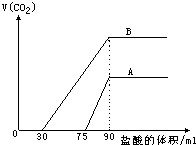
 (1)原NaOH溶液的物质的量浓度为______mol/L.
(1)原NaOH溶液的物质的量浓度为______mol/L.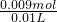 =0.9mol/L,
=0.9mol/L,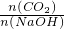 ≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;.
≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;. <
<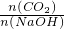 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;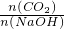 ≤
≤ ,反应按②进行,等于
,反应按②进行,等于 ,时,CO2、NaOH恰好反应生成Na2CO3;小于
,时,CO2、NaOH恰好反应生成Na2CO3;小于 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;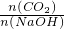 =
=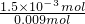 =
=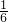 ,小于
,小于 ,所以反应按②进行,NaOH有剩余,溶液中溶质为Na2CO3和NaOH.
,所以反应按②进行,NaOH有剩余,溶液中溶质为Na2CO3和NaOH.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
 (1)原NaOH溶液的物质的量浓度为
(1)原NaOH溶液的物质的量浓度为查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省临沂市苍山县高考补习学校高三(上)期中化学模拟试卷(一)(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2008年上海市闵行区高考化学模拟试卷(解析版) 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2010年吉林省长春实验中学高考化学模拟试卷(三)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com