
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度变化如图所示。据图分析,下列判断正确的是

A. [Ksp[Cu(OH)2]<Ksp[Fe(OH)3]
B. d点代表的溶液中Fe(OH)3已过饱和、Cu(OH)2未饱和
C. 加适量NH4Cl固体可使溶液由a点变到b点
D. b、c两点代表的Fe(OH)3、Cu(OH)2溶解度相等
【答案】B
【解析】A、由b、c两点对应数据可比较出KSP[Fe(OH)3]与Ksp[Cu(OH)2]的大小,Ksp[Fe(OH)3]=c(Fe3+)·(OH-)3=c(Fe3+)·(10-12.7)3,Ksp[Cu(OH)2]=c(Cu2+)·(OH-)2=c(Cu2+)·(10-9.6)2,因c(Fe3+)=c(Cu2+),故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A错误;B、在C点表示Cu(OH)2饱和溶液,在d点铜离子浓度比饱和时小,所以表示不饱和溶液;b点表示Fe(OH)3饱和溶液, d点代表的溶液中Fe(OH)3已过饱和,故B正确;C、向溶液中加入NH4Cl固体,铵根离子与氢氧根离子结合生成一水合氨,会导致溶液中的c(OH-)减小,故不能使溶液由a点变到b点,故C错误;D、曲线为沉淀溶解平衡曲线,曲线上的点为平衡点,已知b、c两点分别处在两条的沉淀溶解平衡曲线上,所以两点均代表溶液达到饱和,物的量浓度数值相等,Fe(OH)3和Cu(OH)2的摩尔质量不同,故溶解度不相同,故D错误。故选B。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
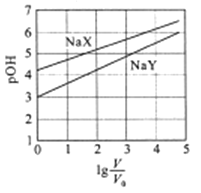
A. HX、HY都是弱酸,且Ka(HX)>Ka(HY)
B. 图中pOH随![]() 变化始终满足直线关系
变化始终满足直线关系
C. ![]() =3时,NaX溶液中所含离子总数小于NaY溶液
=3时,NaX溶液中所含离子总数小于NaY溶液
D. 分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 1molOH﹣的质量为17gmol﹣1
B. 0.5mol H2所占体积约为11.2L
C. 等质量的金刚石和晶体硅所含原子个数之比为7:3
D. 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国是最大的钢铁生产国,钢铁是国民经济的基础产业,铁及其化合物的应用也越来越广泛。回答下列问题:
(1)画出铁的原子结构示意图:______________。
(2)工业炼铁时常用CO还原铁矿粉,已知:
① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= ________。
(3)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) 反应温度与K的关系如右表:
反应温度/℃ | 1000 | 1150 | 1300 |
平衡常数K | 64 | 50.7 | 42.9 |
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。

①前 8minCO 的反应速率为_______;平衡时a=____。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2,平衡_______移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是_______(填标号)。
A.增大Fe2O3用量 B.增大压强 C.降低温度 D.向容器中再充入少量CO
(4)纳米级的Fe3O4在催化剂、造影成像、药物载体、靶向给药等领域都有很好的应用前景,工业生产中常用“共沉淀法”来制备。将FeCl2和FeCl3按一定比例配成混合溶液,用NaOH溶液作为沉淀剂,在特定条件下即可制得纳米级的Fe3O4,反应的离子方程式是_____,在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?________。
(5)纳米铁粉可用于除去废水中的NO3-,反应的离子方程式为:4Fe+ NO3-+ 10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是________;若加入少量Cu2+,废水中NO3-的去除速率大大加快,可能的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如右图所示。下列说法正确的是

A. 放电时,有机阳离子向铝电极方向移动
B. 充电时,外加电源时铝连正极、石墨连负极
C. 放电时负极的电极反应为:4![]() =Al-3e-+7
=Al-3e-+7![]()
D. 该电池的工作原理为:Al+4![]() +3CnAlCl4
+3CnAlCl4  3Cn+4
3Cn+4![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2g甲醛(CH2O)气体溶于6g冰醋酸中,再加入4g果糖得混合物甲;另取5g甲酸甲酯(HCOOCH3)和9g葡萄糖相混合,得混合液乙;然后将甲和乙两种混合液再按7:4的质量比混合得丙,则丙中碳元素的质量分数是
A. 20% B. 35% C. 40% D. 55%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=-lgc(Ba2+),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )

A. 加入BaCl2可以使溶液由c点变到a点
B. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
C. d点表示的是该温度下BaSO4的不饱和溶液
D. 该温度下,Ksp(BaSO4)=1.0×10-24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室探究氨基甲酸铵(NH2COONH4)的分解反应。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
温度/℃ | 15 | 20 | 25 | 30 | 35 |
平衡总压强/kPa | 5.7 | 8.3 | 12 | 17.1 | 24 |
平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
①该可逆反应的平衡常数的表达式为________________________
②可以判断该分解反应已经达到平衡的是________。
A.2v(NH3)=v(CO2)
B.密闭容器中混合气体的密度不变
C.密闭容器中CO2的体积分数不变
D.密闭容器中总压强不变
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25 ℃下达到分解平衡。若在恒温下增大容器体积,氨基甲酸铵固体的质量将________(填“增加”、“减少”或“不变”)。该反应的焓变ΔH______0(填“>”、“=”或“<”,下同),熵变ΔS_______0
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。
已知:①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)+C(s)===2CO(g) ΔH2=+172.5 kJ·mol-1
③S(s)+O2(g)===SO2(g) ΔH3=-296.0 kJ·mol-1
请写出CO与SO2反应的热化学方程式_________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com