

| A. | 该反应属于分解反应 | B. | 图中的两种化合物都属于氧化物 | ||
| C. | 该反应中元素的化合价没有变化 | D. | 反应前后原子的种类改变 |
科目:高中化学 来源: 题型:选择题
| A. | 提高风能、太阳能等可再生清洁能源的使用比例 | |
| B. | 推广CO2再利用技术,将其合成有价值的化学品 | |
| C. | 利用工业废水灌溉农作物,提高水资源的利用率 | |
| D. | 研发煤炭的洁净、高效利用技术,保护生态环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入CaCl2溶液中 | B. | NO2通入FeSO4溶液中 | ||
| C. | NH3通入A1C13溶液中 | D. | SO2通入Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48 g O3中的氧原子数为3NA | |
| B. | 24 g金属镁变为镁离子时失去的电子数为NA | |
| C. | 4℃时9 mL水和标准状况下11.2 L氮气中的原子数均为NA | |
| D. | 2 mol•L-l的CuCl2溶液中含有的氯离子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
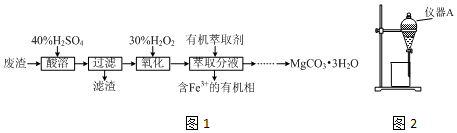
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火炬燃料丙烷充分燃烧后只生成二氧化碳和水 | |
| B. | 撑杆跳高运动员使用的碳纤维撑杆属于有机高分子材料 | |
| C. | 泳池中加入的适量漂白粉可起到杀菌消毒作用 | |
| D. | 举重和体操运动员手上涂抹的碳酸镁白色粉末可吸水防滑 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.00 | 2.92 | 5.47 | 55.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 难溶电解质 | CaCO3 | CaSO4 |
| Ksp | 2.8×10-9 | 9×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
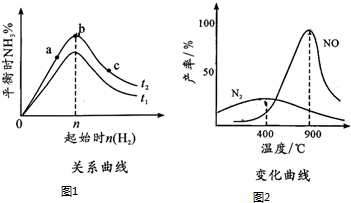
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com