
| A. | 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗 | |
| B. | 装待测液的锥形瓶,洗涤后未干就盛入待测液 | |
| C. | 滴定结束后,用俯视法观察碱式滴定管刻度,其余操作正确 | |
| D. | 滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |
分析 根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:A.未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗,待测液被稀释,物质的量偏小,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故A错误;
B.装待测液的锥形瓶,洗涤后未干就盛入待测液,待测液物质的量不变,对V(标准)无影响,可知c(待测)不变,故B错误;
C.滴定结束后,用俯视法观察碱式滴定管刻度,其余操作正确,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏小,故C错误;
D.滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,可知c(待测)偏大,故D正确;
故选D.
点评 本题主要考查了中和滴定操作的误差分析,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析是解答的关键,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
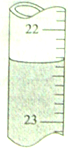 准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:
准确移取25.00mL某未知浓度的NaOH溶液于一洁净锥形瓶中,然后用0.20mol/L的盐酸溶液滴定(指示剂为甲基橙),滴定结果如下:| HCl溶液起始读数 | HCl溶液终点读数 | |
| 第一次 | 2.15mL | |
| 第二次 | 3.10mL | 21.85mL |
| 第三次 | 4.20mL | 22.95mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合后的溶液 | 加入的酸 | 酸的浓度/(mol•L-1) | 混合后溶液的pH |
| ① | HA | 0.10 | 8.7 |
| ② | HB | 0.12 | 2 |
| A. | HA是强酸,HB是弱酸 | |
| B. | 升高温度,溶液②中$\frac{c({B}^{-})}{c(N{a}^{+})}$增大 | |
| C. | 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | HA物质的量 浓度(mol• L-1) | NaOH物质的 量浓度(mol• L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
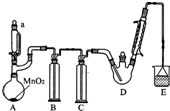 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$(1×10-8+1×10-10)mol/L | B. | (1×10-8+1×10-10)mol/L | ||
| C. | (1×10-14-5×10-5)mol/L | D. | 2×10-10mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 9种 | C. | 13种 | D. | 15种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com