
【题目】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
0 | 1.20 | 0.60 |
5 | 0.80 | |
10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________。
②列式并计算该反应在700℃时的化学平衡常数K=__________,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________(填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4![]() 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3![]() 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
【答案】(1)C(s)+H2O(g)=CO(g)+H2(g) △H=+131.3kJ/mol
该反应的正向混乱度增大或正反应是熵增的反应 (2)AC
(3)①v(H2)=0.04 mol·L-1·min-1 ②K=c(CO2)c(H2)/c(CO)c(H2O)=1 放热 ③ B
【解析】(1)根据题意写出热化学方程式,①C(s)+O2(g)=CO2(g)![]() H=-393.7 kJ/mol,②CO(g)+
H=-393.7 kJ/mol,②CO(g)+![]() O2(g)=CO2(g)
O2(g)=CO2(g)![]() H=-283.0 kJ/mol,③H2(g)+
H=-283.0 kJ/mol,③H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g)![]() H=-242.0 kJ/mol,根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)
H=-242.0 kJ/mol,根据盖斯定律,①-②-③得:C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.5 kJ/mol,。因为该反应
H=+131.5 kJ/mol,。因为该反应![]() H>0、
H>0、![]() S>0,根据化学反应方向的判据:
S>0,根据化学反应方向的判据:![]() HT
HT![]() S可得,在高温下
S可得,在高温下![]() HT
HT![]() S可能小于0,能够正向进行。故答案为:C(s)+H2O(g)=CO(g)+H2(g)
S可能小于0,能够正向进行。故答案为:C(s)+H2O(g)=CO(g)+H2(g)![]() H=+131.5 kJ/mol;该反应的正向混乱度增大或正反应是熵增的反应 。
H=+131.5 kJ/mol;该反应的正向混乱度增大或正反应是熵增的反应 。
(2)A项,当改变某一条件时,正反应速率先增大后减小,说明开始时平衡逆向移动,后来平衡正向移动,反应物浓度降低导致正反应速率减小,故A项正确;B项,化学平衡常数K减少,反应程度减小,所以平衡逆向移动,故B项错误;C项,正反应是气体分子数增大的反应,所以混合气体的平均相对分子质量减少说明气体分子数增大,平衡正向移动,故C项正确;D项,反应物气体体积分数增大,说明平衡逆向移动,故D项错误。综上所述,符合题意的选项为AC。
(3)①根据用不同物质表示的化学反应速率之比=化学方程式计量数之比,5min内用氢气表示的平均速率:v(H2)=v(CO)=(1.200.80)mol÷2L÷5min=0.04 mol·L-1·min-1 ;②由化学方程式,根据已知条件可得,5min时反应已达平衡,列三段式:
CO(g)+H2O(g)![]() CO2(g)+ H2(g)
CO2(g)+ H2(g)
开始( mol·L-1) 0.60 0.30 0 0
转化( mol·L-1) 0.20 0.20 0.20 0.20
平衡( mol·L-1) 0.40 0.10 0.20 0.20
K=![]() =
=![]() =1;因为温度升至800℃,平衡常数为0.64<1,所以升温,化学平衡逆向移动,正反应为放热反应。③由题意CO2为0.4mol,NaOH为0.4mol,所以恰好反应生成0.4mol NaHCO3,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A项正确;B项,根据HCO3-水解常数Kh=Kw/Ka=
=1;因为温度升至800℃,平衡常数为0.64<1,所以升温,化学平衡逆向移动,正反应为放热反应。③由题意CO2为0.4mol,NaOH为0.4mol,所以恰好反应生成0.4mol NaHCO3,根据电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A项正确;B项,根据HCO3-水解常数Kh=Kw/Ka=![]() >Ka,所以HCO3-水解程度大于电离程度,因此c(H2CO3)>c(CO32-),故B项错误;C项,由物料守恒:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)和电荷守恒:c(Na+)+c(H
>Ka,所以HCO3-水解程度大于电离程度,因此c(H2CO3)>c(CO32-),故B项错误;C项,由物料守恒:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)和电荷守恒:c(Na+)+c(H![]() H++CO32-,可得Ka(HCO3-)=
H++CO32-,可得Ka(HCO3-)=![]() =
=![]() =4×10-11,因此c2(CO32-)=4×10-11,所以c(CO32-)×c(Ca2+)=
=4×10-11,因此c2(CO32-)=4×10-11,所以c(CO32-)×c(Ca2+)=![]() >Ksp(CaCO3)=3×10-9,有白色沉淀析出,故D项正确。综上所述,符合题意的选项为B。
>Ksp(CaCO3)=3×10-9,有白色沉淀析出,故D项正确。综上所述,符合题意的选项为B。


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是

A. N4属于一种新型的化合物
B. N4分子中存在非极性键
C. N4分子中N—N键角为109°28′
D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
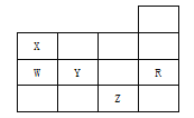
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. Y的氢化物的沸点比H2O的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )

A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O +![]() O2 + Q
O2 + Q
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在4种离子:NO3-、SO42-、Mg2+、Na+,其中SO42-、Mg2+、Na+ 物质的量之比为1:2:2,则NO3-与SO42-物质的量之比为( )
A.1:2 B.3:1 C.4:1 D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.4molNa2SO3恰好被0.1mol氧化剂X2O72-氧化生成Na2SO4,则元素X在还原产物中的化合价是
A.+6 B.+3 C.+2 D.0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com