


科目:高中化学 来源: 题型:
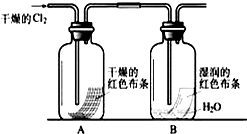 某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验.
某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| B、取相同浓度的NaCl溶液和NaClO溶液,NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度 |
| C、某盐的溶液呈酸性,该盐一定发生了水解反应 |
| D、pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验内容 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO3 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 除去氯化钙溶液中的氯化铁杂质 | 生石灰 | 调节溶液的pH为3.7,再过滤 |
| ④ | 鉴别AlCl3溶液和MgCl2溶液 | 氨水 | 产生白色沉淀然后消失的是AlCl3溶液 |
| A、①③ | B、①②③ |
| C、②④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X>Z>Y>W |
| B、Z>W>X>Y |
| C、Z>X>Y>W |
| D、Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:
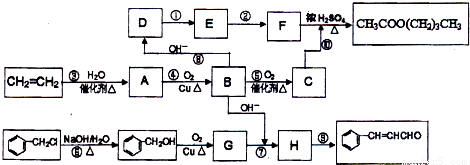

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫在氧气中燃烧发出淡蓝色火焰 |
| B、硫在氧气中燃烧产生无色无味的气体 |
| C、铁丝在氧气中燃烧火星四射,生成黑色固体 |
| D、木炭在氧气中燃烧发出耀眼的红光 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H+ |
| Fe2+ |
| OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com