
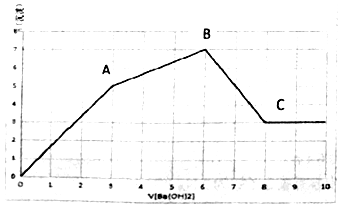
 向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )
向Al2(SO4)3和AlCl3的混合溶液中,逐滴加入Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和生成沉淀的物质的量的关系如图所示.下列说法正确的是( )| A. | OA段反应的离子方程式为Al3++3OH-+Ba2++SO42-=Al(OH)3↓+BaSO4↓ | |
| B. | B点对应的溶液中,Na+、CO32-、NO3-可以大量共存 | |
| C. | C点对应的溶液中,通入过量的CO2气体有白色沉淀生成 | |
| D. | 原溶液中Al2(SO4)3和AlCl3的物质的量之比为1:1 |
分析 A.由图象分析得OA段发生的反应为Al2(SO4)3和Ba(OH)2反应生成Al(OH)3和BaSO4;
B.由图象分析得AB段发生的反应为AlCl3和Ba(OH)2反应生成Al(OH)3和BaCl2,故溶质为BaCl2中Ba2+与CO32-不能共存;
C.由图象分析得BC段发生的反应为Al(OH)3和Ba(OH)2反应,故离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故溶质中含有,能与气体CO2反应,此方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故有沉淀生成;
D.据Al2(SO4)3~3Ba(OH)2,2AlCl3~3Ba(OH)2,之间的关系进行计算.
解答 解:A.由图象分析得OA段发生的反应为Al2(SO4)3和Ba(OH)2反应生成Al(OH)3和BaSO4,故离子方程式为2Al3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Al(OH)3↓,故A错误;
B.由图象分析得AB段发生的反应为AlCl3和Ba(OH)2反应生成Al(OH)3和BaCl2,故溶质为BaCl2中Ba2+与CO32-不能共存,故B错误;
C.由图象分析得BC段发生的反应为Al(OH)3和Ba(OH)2反应,故离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故溶质中含有,能与气体CO2反应,此方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故有沉淀生成,故C正确;
D.Al2(SO4)3~3Ba(OH)2,
1 3
1×10-3c 3×10-3c
2AlCl3~3Ba(OH)2
2 3
$\frac{4}{3}$×10-3c 2×10-3c,故Al2(SO4)3和AlCl3的物质的量之比为 1×10-3c:$\frac{4}{3}×1{0}^{-3}$c=3:4,故D错误;
故选C.
点评 理清反应的整个过程,问题即可解决,可以利用方程式计算,也可以用原子守恒计算.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝可作胃酸的中和剂 | |
| B. | 绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属元素的化合物 | |
| C. | SiO2、NaOH、HF三者两两均能反应 | |
| D. | 制备单晶硅的过程中不发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| B | 通入CO2,溶液变浑浊;继续通CO2至过量,浑浊不消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊;再加入品红溶液,溶液为红色 | Ca(ClO)2溶液 |
| D | 通入SO2,溶液没有明显变化;再通入氨气,溶液变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 选用的试剂 | 操作方法 |
| ① | CaO(CaCO3) | 水 | 溶解、过滤、结晶 |
| ② | CO2(CO) | 氧气 | 点燃 |
| ③ | CuSO4(H2SO4) | 氢氧化钠溶液 | 过滤 |
| ④ | Cu(CuO) | 稀盐酸 | 溶解、过滤、洗涤、干燥 |
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol苯分子中含有碳碳双键数为3NA | |
| B. | 常温下,0.1 mol乙烷与乙烯混合气体中所含碳原子数为0.2NA | |
| C. | 14 g乙烯和丙烯的混合气体中所含原子总数为2NA | |
| D. | 标准状况下,22.4 L己烷中共价键数目为19NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B>A | |
| B. | 原子序数:D>C>B>A | |
| C. | 原子半径:A>B>C>D | |
| D. | 最高价氧化物的水化物碱性:A>B,酸性:C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | t/min C/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com