
 某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )
某气态不饱和链烃CnHm与H2反应生成CnHm+n,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同.反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知n的数值是( )| A. | 2 | B. | 4 | C. | 6 | D. | 8 |
分析 不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,氢气为40mL时,反应后混合气体体积最小,为20mL,反应前CmHn的体积=60mL-40mL=20mL,相同条件下,气体体积之比等于物质的量之比,根据原子守恒确定n的值.
解答 解:不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,氢气为40mL时,反应后混合气体体积最小,为20mL,反应前CmHn 的体积=60mL-40mL=20mL,故CmHn、H2、CmHn+n的物质的量之比=20mL:40mL:20mL=1:2:1,则反应为:CmHn+2H2$\stackrel{一定条件}{→}$CmHn+n,根据H原子守恒,则n=4,
故选B.
点评 本题以化学反应图象为载体,考查化学方程式的有关计算,关键是明确不饱和烃与氢气恰好反应时反应后混合气体的总体积最小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度之比为l:3:2 | |
| C. | 达到化学平衡时'容器内气体的平均摩尔质量不再变化 | |
| D. | 达到化学平衡时,正反应和逆反应的速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式是:CH2=CH2 | B. | 乙醇的分子式是:CH3CHO | ||
| C. | 甲烷的结构式是:CH4 | D. | 乙酸的官能团是:-OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
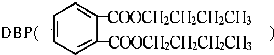 是一种常见的塑化剂,
是一种常见的塑化剂,

 .
. .
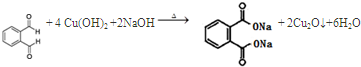
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、CO32- | B. | H+、Ba2+、NO3-、HCO3- | ||
| C. | Ba2+、Mg2+、Cl-、OH- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.
氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com