
恒温下,反应aX(g) 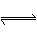 bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是
A.a>b+c B.a<b+c C.a=b+c D.a=b=c
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是( )
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质在溶液中最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是 ( )
A.2∶3 B.3∶2 C.4∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
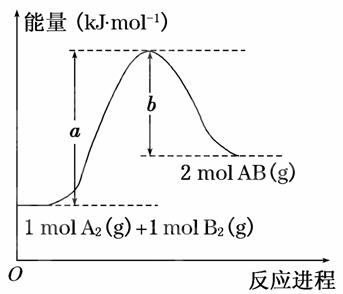
A.每生成2分子AB吸收b kJ热量
B.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
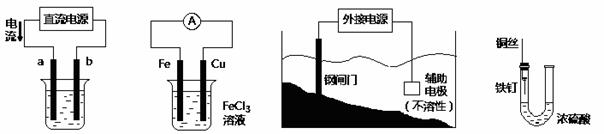
① ② ③ ④
 A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA
B.30g甲醛中含电子对数为4NA
C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA
D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(一) 尿素又称碳酰胺,是含氮量最高的氮肥,工业上利用二氧化碳和氨气在一定条件下合成尿素。其反应分为如下两步:
第一步:2NH3(l)+CO2(g) 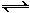 H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= —330.0 kJ·mol-1
第二步:H2NCOONH4(l) 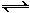 H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2= + 226.3 kJ·mol-1
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 m3 密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
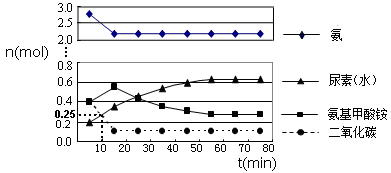
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定。
②反应进行到10 min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= mol/(L·min)。
③当反应在一定条件下达到平衡,若在恒温、恒容下再充入一定量气体He,则CO(NH2)2(l)的质量_________(填“增加”、“减小”或“不变”)。
(二)氨是制备尿素的原料,NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
氨气溶于水得到氨水,在25℃下,将amol/L的氨水与bmol/L的硫酸以3∶2体积比混合反应后溶液呈中性。用含a和b的代数式表示出氨水的电离平衡常数为_________。
(三)氢气是合成氨的原料。“氢能”将是未来最理想的新能源。
(1)在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
(2)氢气通常用生产水煤气的方法制得。其中C(s)+ H2O(g)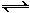 CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
CO(g)+H2(g),在850℃时平衡常数K=1。若向1升的恒定密闭真空容器中同时加入x mol C和6.0mol H2O。
①当加热到850℃反应达到平衡的标志有______________ 。
A.容器内的压强不变 B.消耗水蒸气的物质的量与生成CO的物质的量相等
C.混合气的密度不变 D.单位时间有n个H-O键断裂的同时有n个H-H键断裂
②x应满足的条件是 。
(四)CO2是合成尿素的原料,但水泥厂生产时却排放出大量的CO2。华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:
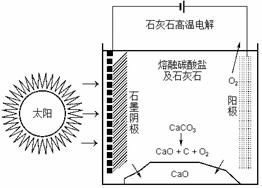
(1)上述生产过程的能量转化方式是 。
(2)上述电解反应在温度小于900℃时进行碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,则阳极的电极反应式为 ,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的物质是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.全部 B.①②③ C.①②③⑤ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E为短周期主族元素,它们的原子序数依次增大。请回答下列问题。
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是: I1=738kJ/mol I2 = 1451 kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D | 元素的主族序数与周期数的差为3 |
| E | 元素是该周期电负性最大的元素 |
(1)B基态原子中能量最高的电子,其电子云在空间有 个伸展方向,原子轨道呈 形。B与A能形成多种形式的化合物,其中BA5属于离子晶体,其电子式为 。
(2)C的单质在一种常见的非金属氧化物中剧烈燃烧生成黑、白两种固体,写出该反应的化学方程式 ;其中的白色固体可用作耐火材料,它属于 晶体。
(3)BE3 在常温下是一种淡黄色的液体,构成其晶体的微粒之间的作用力是 ,它遇水即发生水解可生成一种具有漂白性的物质,写出反应的化学方程式 ,该反应说明其中B和E中非金属性较强的是 (填元素的符号)。
(4)DO2气体通入足量Ba(BO3)2的溶液,生成白色沉淀和无色气体,有关反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com