
| 压强(标准大气压) | 1 | 5 | 10 | 100 |
| SO2转化率(%) | 93.5 | 96.9 | 97.8 | 99.3 |
分析 (1)正反应放热,且反应物气体的计量数之和大于生成物,以此判断;
(2)①采用500℃,此时催化剂活性最大;
②不断鼓入空气,氧气浓度增大,平衡正向移动;
③1标准大气压下转化率已经很大,增大压强,对设备具有更高要求.
解答 解:(1)正反应放热,且反应物气体的计量数之和大于生成物,应增大压强,可加快反应速率,又能提高SO2转化率,故答案为:增大压强;
(2)①正反应为放热反应,升高温度平衡逆向移动,不利于增大转化率,但采用500℃,此时催化剂活性最大,反应速率最大,故答案为:催化剂活性最大;
②不断鼓入空气,氧气浓度增大,平衡正向移动,可增大二氧化硫的转化率,故答案为:增大二氧化硫的转化率;
③由表中数据可知,增大压强对SO2的转化率影响不大,同时增大成本,故通常采取采用常压而不是高压,故答案为:常压时的转化率较高、高压成本高.
点评 本题考查化学平衡的影响,为高频考点,侧重考查学生的分析能力,题目侧重化学与生产的考查,有利于培养学生良好的科学素养,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 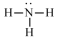 氨分子的结构式 | B. | 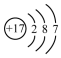 Cl-结构示意图 | C. | 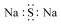 Na2S的电子式 | D. | 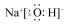 NaOH的电子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液 | |
| B. | 定容时,观察液面俯视刻度线 | |
| C. | 摇匀后,液面低于刻度线,没有再加蒸馏水 | |
| D. | 用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数减小 | D. | X的转化率下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ③④⑤ | C. | ②④⑥ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “物质的量”是衡量物质重量的物理量 | |
| B. | 氢氧化钠的摩尔质量是40g | |
| C. | 物质的量浓度的常用单位是mol•L-1 | |
| D. | 1mol任何物质所占有的体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、熔融状态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①④ | B. | ①④②③ | C. | ④①②③ | D. | ②③①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com