
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2<Q1<Q | D. | Q=Q1>Q2 |
分析 2SO2(g)+O2(g)?2SO3(g),△H=-QkJ/mol,表示在上述条件下2mol SO2和1molO2完全反应生成1molSO3气体放出热量为QkJ,再结合可逆反应中反应物不能完全反应解答.
解答 解:反应的热化学方程式为:2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol,
由热化学方程式可知,在上述条件下反应生成2molSO3气体放热QkJ,加入2mol SO2和1molO2,生成的三氧化硫量小于2mol,所以Q1<Q,
通入1mol SO2和0.5molO2,如果转化率与加入2mol SO2和1molO2相同,则放热为$\frac{{Q}_{1}}{2}$kJ,但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,所以实际放出的热量<$\frac{{Q}_{1}}{2}$kJ,即2Q2<Q1,综上得:2Q2<Q1<197kJ,所以Q2<Q1<Q,
故选C.
点评 本题考查反应热的计算,题目难度中等,本题注意浓度对平衡的影响以及可逆反应的特征.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 中子数为20的氯原子符号:20Cl | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HClO4的电离方程式:HClO4═H++ClO4- | |
| D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN的结构式:H-C≡N | |
| B. | HClO的电子式: | |
| C. | 中子数为16的硫原子符号为:${\;}_{32}^{16}$S | |
| D. | Na+的离子结构示意图: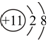 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题:
X、Y、Z、M、Q是五种短周期主族元素,原子序数依次增大.X、Y可形成最常用溶剂;X、Y、Z最外层电子数之和为8;Y、M形成的气态化合物在标准状况下的密度为2.86g•L-1.请回答下列问题: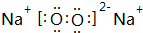 ;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;将A加入盛有酚酞试液的试管中观察到的现象为有大量气泡生成,溶液先变红后褪色,发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1L溶液中含有0.3NA个K+离子 | |
| B. | 1L溶液中含有K+和SO42-离子总数为0.9NA | |
| C. | 2L溶液中含K+的物质的量浓度为1.2mol/L | |
| D. | 2L溶液中含0.6NA个SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com