
某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是

A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g);△H>0学科网
2C(g);△H>0学科网
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向逆反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
D
【解析】
试题分析:A、由图I可知,A、B的浓度分别减小(0.5-0.3)mol/L=0.2mol/L、(0.7-0.1)mol/L=0.6mol/L,C的浓度增加0.4mol/L,则三者的浓度的变化的比值为0.2:0.6:0.4=1:3:2,所以该反应的化学方程式可表示为A(g )+3B(g) 2C(g);由图II可知T1>T2,随温度升高,B的体积分数增大,说明升高温度,平衡逆向移动,则正反应是放热反应,△H<0,错误;B、达到平衡后,若其他条件不变,通入稀有气体,各物质的浓度不变,所以平衡不移动,错误;C、达到平衡后,若其他条件不变,减小体积,则压强增大,平衡向气体物质的量减小的方向移动,所以平衡正向移动,错误;D、升高温度,正逆反应的速率都增大,平衡向吸热反应方向移动,所以平衡逆向移动,则A的转化率减小,正确,答案选D。
2C(g);由图II可知T1>T2,随温度升高,B的体积分数增大,说明升高温度,平衡逆向移动,则正反应是放热反应,△H<0,错误;B、达到平衡后,若其他条件不变,通入稀有气体,各物质的浓度不变,所以平衡不移动,错误;C、达到平衡后,若其他条件不变,减小体积,则压强增大,平衡向气体物质的量减小的方向移动,所以平衡正向移动,错误;D、升高温度,正逆反应的速率都增大,平衡向吸热反应方向移动,所以平衡逆向移动,则A的转化率减小,正确,答案选D。
考点:考查化学平衡图象的分析,条件对平衡的影响


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源:2014-2015广东省汕头市高一上学期10月月考化学试卷(解析版) 题型:选择题
下列物质中,不能与氢氧化钠溶液发生反应的是
A.Mg B.Al(OH)3 C.Al D.CO2
查看答案和解析>>
科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
选考题【化学一一选修化学与技术】(15分)以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下:
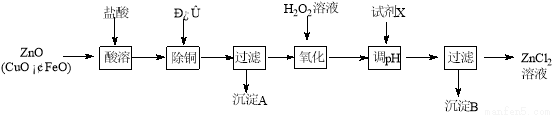
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1. 1 | 3. 2 |
Zn2+ | 5. 2 | 6. 4 |
Fe2+ | 5. 8 | 8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是 (选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3 ;d.ZnSO4;pH应调整到 ;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 ;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 ;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高三上学期期末联考理综化学试卷 (解析版) 题型:选择题
下列说法中不正确的是
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线绞接在一起;
②汽车尾气中含有能污染空气的氮的氧化物,原因是汽油燃烧不充分
③用新制备的Cu(OH)2悬浊液与病人尿液共热,可检验病人尿液中是否含有葡萄糖;
④某雨水样品采集后放置一段时间,pH值由4.68变为4.28,是因为水中溶解了较多的CO2
⑤明矾可以用于净水,主要是由于铝离子可以水解得到氢氧化铝;
⑥“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
A.②③⑤ B.①②④ C.③④⑥ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省协作体高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O NH4HCO3;NH4HCO3+NaCl NaHCO3↓+NH4Cl ;2NaHCO3  Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ,其作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入_______气体,说明原因_________________________
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 。
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为 。
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:填空题
(14分)硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在 500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
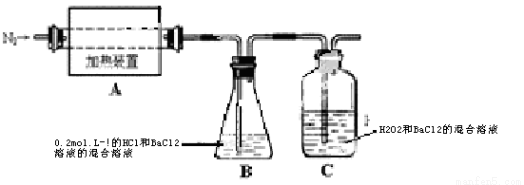
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液 B.稀硫酸 C.浓盐酸 D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
(3)已知亚铁离子被氧气氧化的反应是:4Fe2+ + O2 + (4+2x) H2O 2Fe2O3?xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
2Fe2O3?xH2O + 8H+,硫酸亚铁铵 溶液较硫酸亚铁溶液不易被氧气氧化,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
0.44 g铜镁合金完全溶解于100 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体336 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到0.78 g沉淀。下列说法正确的是
A.该合金中铜与镁的质量量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是7.0 mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到0.78 g沉淀时,加入NaOH溶液的体积是1380mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:填空题
(7分)有机物A的结构简式为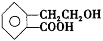 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)写出有机物A中官能团的名称: 、 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式 。
(4)A制备E的过程中可能会生成一种高分子化合物,写出其结构简式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
将15g两种金属的混合物投入足量的盐酸中,反应完全后得到H2 11.2L(标准状况)该混合物的组成可能是
A.钠和铁 B.镁和铜 C.铝和镁 D.锌和铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com