
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
科目:高中化学 来源: 题型:解答题
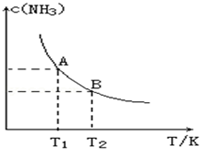 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO32-+H2O?HCO3-+OH-:用热的纯碱溶液清洗油污 | |
| B. | A13++3H2O?AI(OH)3(胶体)+3H+:明矾净水 | |
| C. | SnCl2+H2O?Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| D. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+3H+:制备TiO2纳米粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一次实验平衡时反应放出的热量为294.9kJ | |
| B. | 两次实验平衡时,SO2的转化率相等 | |
| C. | 第二次实验达平衡时SO3的体积分数大于$\frac{2}{9}$ | |
| D. | 达平衡时,O2表示的反应速率为0.25mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器换号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH2(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分解反应 | B. | 置换反应 | C. | 复分解反应 | D. | 化合反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com