
【题目】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路,B的简单氢化物的水溶液呈碱性,E元素的正三价离子的3d亚层为半充满,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族。
(1)A、B、C三种元素的第一电离能由小到大的顺序为______________________,电负性由小到大的顺序为____________________。
(2)B的简单氢化物易液化的原因是_______________;BH4+中B原子的杂化方式为___________,空间构型为__________________。
(3)E元素基态原子的电子排布式为____________________________________。
(4)B和C形成的化合物常用作高温耐火材料,化学性质稳定,据此推测它应属于__________________晶体。
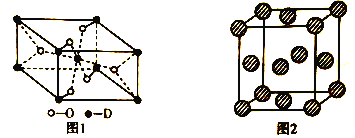
(5)D有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中D的配位数为__________________;图2为E的一种面心立方晶胞结构,若晶胞的边长为acm,NA表示阿伏加德罗常数的值,则E的密度为__________________g·cm-3(用含a和NA的代数式表示)。
【答案】 )Si<C<N Si<C<N 分子间存在氢键 sp3 正四面体 1s22s22p63s23p63d64s2或[Ar]3d64s2 原子 6 ![]()
【解析】A、B、C、D、E代表原子序数依次增大的前四周期元素,其中A和C为同一主族,C常用于制作半导体器件和集成电路则C为硅元素,故A为碳元素,B的简单氢化物的水溶液呈碱性则B为氮元素,E元素的正三价离子的3d亚层为半充满,则为铁元素,D被称为“未来金属”,其重量轻、强度高、耐腐蚀,其在周期表中位于第4周期、第ⅣB族,则为钛元素。(1)C、N元素都是第二周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<N,C、Si同主族,自上而下第一电离能呈减小趋势,故第一电离能大小顺序为Si<C<N;元素非金属性越强电解性越大,故电负性由小到大的顺序为Si<C<N;(2)B的简单氢化物氨气易液化的原因是分子间存在氢键;NH4+中中含有4个键,没有孤电子对,N原子的杂化方式为sp3杂化,空间构型为正四面体;(3)E为钛元素,基态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;(4)B和C形成的化合物氮化硅常用作高温耐火材料,化学性质稳定,据此推测它应属于原子晶体;(5)铁有多种氧化物,其中一种氧化物的晶胞结构如图1所示,则该晶体中铁原子相当于在氧原子形成的体心中,故配位数为6;图2为铁的一种面心立方晶胞结构,铁原子为8×![]() +6×
+6×![]() =4个,若晶胞的边长为acm,体积为a3cm3,NA表示阿伏加德罗常数的值,则密度为
=4个,若晶胞的边长为acm,体积为a3cm3,NA表示阿伏加德罗常数的值,则密度为![]() g·cm-3=
g·cm-3=![]() g·cm-3。
g·cm-3。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列有机化合物中均含有酸性杂质,除去这些杂质的方法中正确的是( )
A. 乙酸丁酯中含乙酸杂质:加入饱和碳酸钠溶液洗涤,分液
B. 乙醇中含乙酸杂质:加入碳酸钠溶液洗涤,分液
C. 乙醛中含乙酸杂质:加入氢氧化钠溶液洗涤,分液
D. 苯中含苯酚杂质:加入溴水,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期主族元素。已知Z是地壳中含量第二位的元素,W在短周期主族元素中原子半径最大,Z、X、Y在元素周期表中的相对位置如图所示。下列说法正确的是

A. Z的氧化物属于酸性氧化物,能与水反应生成相应的酸
B. W2Y和W2Y2中阴、阳离子的个数比相同,化学键类型不完全相同
C. X、Y与氢三种元素形成的物质中一定不含离子键
D. X和Y只能形成一种物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g·100mL-1)。
Ⅰ.实验步骤
(1)配制100ml待测白醋溶液:用(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴作指示剂。![]()
(3)读取盛装0.1000 mol·L-1 NaOH 溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为mL。
(4)滴定。当时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00[ | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
①按实验所得数据,可得c(市售白醋)=mol·L-1;
市售白醋总酸量=g·100 mL-1。
②在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法,直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
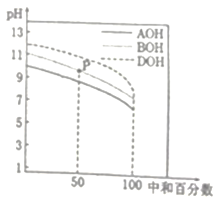
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素且原子序数依次増大,质子数之和为40。B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E的最高价氧化物的水化物呈两性。
(1)B元素在周期表中的位置为_______。
(2)由A、C、D三种元素组成的化合物的电子式为_______。
(3)废印刷电路版上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。現改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,试写出反应的化学方程式______。
(4)若BA3与C2可形成燃料电池,电解质为KOH溶液,则负极的电极反应式为______。(氧化产物不污染环境)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,这四种元素形成的单质依次为m、n、p、q;x、y、z是由这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-lw溶液中,![]() =1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
=1.0×10-10。上述物质的转化关系如图所示,下列说法正确的是
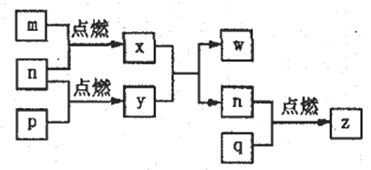
A. 原子半径的大小:a<b<c<d
B. 简单氢化物的沸点:b>d
C. y的电子式:![]()
D. y、w含有的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com