
| ||
| ||
| ||
| ||
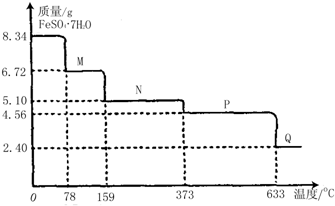
| 20g |
| 100g/mol |
| ||
| 9g×100 |
| 60 |
| ||
| 5g |
| 100g/mol |
| 17.4g |
| 116g/mol |


科目:高中化学 来源: 题型:
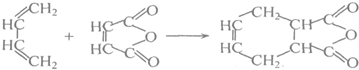
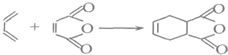
查看答案和解析>>
科目:高中化学 来源: 题型:
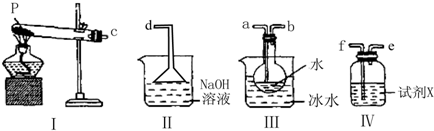
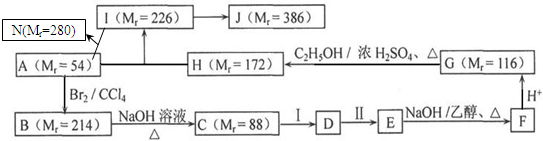
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
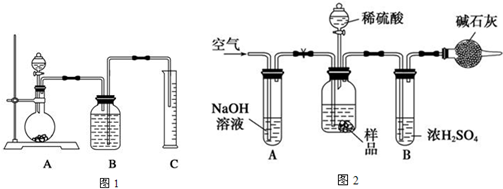
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验买来的奶粉中是否加有淀粉 |
| B、检验自来水中是否含有Cl- |
| C、除去保温瓶中的水垢 |
| D、洗去白色衣服上的番茄汁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com