
【题目】磷单质及其化合物有着广泛应用。
(1)在1.0 L密闭容器中放入0.10mol PCl5(g),一定温度进行如下反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1
PCl3(g)+Cl2(g) ΔH1
反应时间(t)与容器内气体总压强(p/100kPa)的数据见下表:
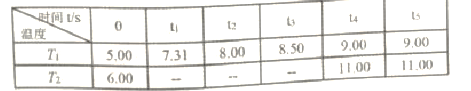
回答下列问题:
①PCl3的电子式为_______。
②T1温度下,反应平衡常数K=______。
③T1___T2(填“>”、“<”或“=”,下同),PCl5的平衡转化率α1(T1) __α2(T2)。
(2)PCl5、PCl3可转化为H3PO4、H3PO3。已知下列热化学方程式:
PCl5(g)+4H2O(l) = H3PO4(aq)+5HCl(aq) ΔH2
PCl3(g)+3H2O(l) = H3PO3(aq)+3HCl(aq) ΔH3
H3PO3(aq)+Cl2(g)+H2O(l) = H3PO4(aq)+2HCl(aq) ΔH4
则ΔH4= ______。(用ΔH1、ΔH2、ΔH3表示)
(3)次磷酸钴[Co(H2PO2)2]广泛用于化学镀钴,以金属钴和次磷酸钠为原料,采用四室电渗析槽电解法制备,原理如下图。
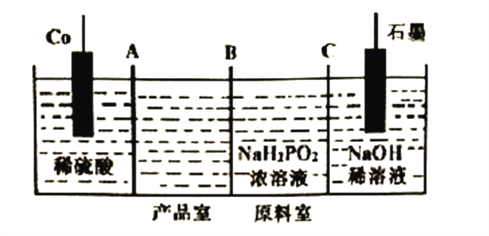
①Co的电极反应式为______________,A、B、C为离子交换膜,其中B为__________离子交换膜(填“阳”或“阴”)。
②次磷酸(H3PO2)为一元弱酸,次磷酸钠溶液中离子浓度由大到小的顺序是__________。
【答案】 ![]() 0.32 mol·L-1 < < ΔH2-ΔH1-ΔH3 Co-2e-=Co2+ 阴 c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
0.32 mol·L-1 < < ΔH2-ΔH1-ΔH3 Co-2e-=Co2+ 阴 c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
【解析】(1). ①.P原子最外层有5个电子,Cl原子最外层有7个电子,P原子与3个Cl原子形成3个共用电子对,PCl3的电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②. 在恒温恒容的密闭容器中,容器内气体的总压强之比等于气体的总物质的量之比,根据平衡三段式法有:
PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始量(mol) 0.1 0 0
转化量(mol) x x x
平衡量(mol) 0.1-x x x
平衡时气体总物质的量为:(0.1-x+x+x)=(0.1+x)mol,则有:![]() =
= ![]() ,x=0.08mol,所以T1温度下,反应平衡常数K=
,x=0.08mol,所以T1温度下,反应平衡常数K=![]() =0.32 mol·L-1,故答案为:0.32 mol·L-1;
=0.32 mol·L-1,故答案为:0.32 mol·L-1;
③. 在1.0 L密闭容器中放入0.10mol PCl5(g),由表中数据可知,在时间为0时,T1对应的气体总压强小于T2对应的气体总压强,因相同条件下温度越高,气体的压强越大,所以T1<T2,在温度为T2时,根据平衡三段式法有:
PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
起始量(mol) 0.1 0 0
转化量(mol) y y y
平衡量(mol) 0.1-y y y
平衡时气体总物质的量为:(0.1-y+y+y)=(0.1+y)mol,则有:![]() =
= ![]() ,y=0.083mol,x=0.08mol<y=0.083mol,所以在温度为T2时PCl5的平衡转化率更大,即α1(T1) <α2(T2),故答案为:<;<;
,y=0.083mol,x=0.08mol<y=0.083mol,所以在温度为T2时PCl5的平衡转化率更大,即α1(T1) <α2(T2),故答案为:<;<;
(2). 已知:① PCl5(g)![]() PCl3(g)+Cl2(g) ΔH1、② PCl5(g)+4H2O(l) = H3PO4(aq)+5HCl(aq) ΔH2 ③ PCl3(g)+3H2O(l) = H3PO3(aq)+3HCl(aq) ΔH3,根据盖斯定律,②-①-③得H3PO3(aq)+Cl2(g)+H2O(l) = H3PO4(aq)+2HCl(aq),所以ΔH4=ΔH2-ΔH1-ΔH3,故答案为:ΔH2-ΔH1-ΔH3;
PCl3(g)+Cl2(g) ΔH1、② PCl5(g)+4H2O(l) = H3PO4(aq)+5HCl(aq) ΔH2 ③ PCl3(g)+3H2O(l) = H3PO3(aq)+3HCl(aq) ΔH3,根据盖斯定律,②-①-③得H3PO3(aq)+Cl2(g)+H2O(l) = H3PO4(aq)+2HCl(aq),所以ΔH4=ΔH2-ΔH1-ΔH3,故答案为:ΔH2-ΔH1-ΔH3;
(3). ①. 以金属钴和次磷酸钠为原料,用电解法制备次磷酸钴[Co(H2PO2)2],Co的化合价从0价升高到+2价,则Co的电极反应式为Co-2e-=Co2+,产品室可得到次磷酸钴的原因是:阳极室的Co2+通过阳离子交换膜进入产品室,原料室的H2
②. 次磷酸(H3PO2)为一元弱酸,在次磷酸钠溶液中,H2PO2-水解使溶液呈碱性,溶液中各离子浓度的大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+),故答案为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验现象或事实解释正确的是( )。
选项 | 实验现象或事实 | 解释 |
A | 检验待测液中S | 先滴入盐酸可排除Ag+、C |
B | 制备乙酸乙酯时,导管应伸入试管至饱和Na2CO3溶液的液面上方 | 乙酸乙酯易溶于碳酸钠溶液,防止发生倒吸 |
C | 向Fe(NO3)2溶液中加入稀硫酸,试管口有红棕色气体产生 | 溶液中N |
D | 含Mg(HCO3)2的硬水长时间充分加热,最终得到的沉淀物的主要成分为Mg(OH)2,而不是MgCO3 | Ksp(MgCO3)<Ksp[Mg(OH)2] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列说法错误的是
A.铝合金大量用于高铁建设B.活性炭具有除异味和杀菌作用
C.生石灰可用作袋装食品干燥剂D.光束通过云、雾会产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据最新报道,贵州发现超大型锰矿,整个矿区资源量超两亿吨。锰矿是继铁矿、铝矿之后,排在第三位的金属矿产,属国家战略紧铁矿产之一,在电池、磁性新材料等方面都有广泛应用。中国是全球最大的锰矿石和锰系材料生产、清费大国,回答下列问题:
(1)基态锰原子的价层电子排布式为_________。
(2)铜锰氧化物(CuMn2O4) 能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
①CO 和N2 互为等电于体。CO 分子中σ键和π键数目之比为________。
②HCHO分子的H-C-H 键角______(填“大于”“小于”或“等于”)CO2的键角,理由是__________。
③ 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶被中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。CO32-的空间构型是____________。
(3)晶体熔点: Fe2O3晶体______Al2O3晶体(填“>”“<”或“=”),理由是___________。
(4)锰、铁的第三电离能(I3) 较大的是_______(填素符号)。
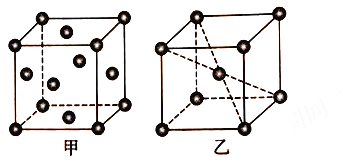
(5) 铝晶胞如图26甲所示。铝晶胞中,铝原子的配位数为________。已知铝的晶体密度为ρ g·cm-3,N A代表阿伏加德罗常数的值,设铝原子的半径为rpm,则r=_______。
(6)锰晶胞如图乙所示。已知锰晶胞参数为a nm。设锰晶胞中两个锰原子核之间最短距离为dnm,则d=_____。锰晶胞中Mn 的空间利用率φ=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有32 g某气体,摩尔质量为16 g·mol-1,则:
①该气体为___________ mol。
②该气体所含分子数为___________ NA。
③该气体在标准状况下的体积为_________ L。
(2) _________g H2O中的氧原子数目与标准状况下4.48 L CO2中的氧原子数目相同。
(3)同温同压下,同体积的氨气(NH3)和氧气的质量比是______,相同质量的氨气和氧气的体积比是_________;
(4)某元素1个原子的质量为a g,1 个 12C原子质量为b g,则该元素的这种原子的相对原子质量数值是_________或_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取较纯的一氯乙烷,用下列哪种方法最好
A. 乙烷和氯气取代 B. 乙烯与氢气加成,再用氯气取代
C. 乙烯和氯化氢加成 D. 乙炔和氯化氢加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列化学实验安全的有关问题:
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的______。
A.  B.
B. C.
C. D.
D.
(2)下列做法正确的是__________(填序号)。
①蒸发时,用手直接拿蒸发皿
②实验室中用![]() 制备并用排水法收集
制备并用排水法收集![]() ,实验结束时,先撤酒精灯,再撤导气管
,实验结束时,先撤酒精灯,再撤导气管
③给试管中的液体加热时,试管口不要朝着任何人
④向燃着的酒精灯中添加酒精
⑤熄灭酒精灯时应用灯帽盖灭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态烃X在标准状态下的密度为1.16 g/L,A能发生银镜反应,E具有特殊香味,有关物质的转化关系如下:

请回答:
(1)B中含有的官能团名称是_____________,反应④的反应类型为_____________。
(2)写出反应①的化学方程式_____________。
(3)下列说法正确的是_____________。
A.有机物D在加热条件下可以使黑色的氧化铜变红
B.有机物A分子中的所有原子在同一平面上
C.有机物B与C在一定条件下可以反应生成有机物E
D.有机物E中混有B和D,可用NaOH溶液将E分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,SO2与NaOH反应后的溶液中存在含硫微粒H2SO3、HSO3-和SO32-,三者中各自所占的物质的量分数随溶液pH变化的关系如图所示。下列说法正确的是

A. a表示SO32-物质的量分数随溶液pH变化的曲线
B. pH=8昀溶液中:c(HSO3-)>c(SO32-)
C. pH=7的溶液中:c(Na+)= c(HSO3-)+2c(SO32-)
D. 1mol/L的NaHSO3溶液中存在: c(H2SO3)=c(H+)+c(OH-)+c(SO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com