

分析 由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2,
(1)无色的NO在常温下与空气中的O2迅速化合生成红棕色N02;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,根据Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃判断产物;根据氢氧化铝显两性能与碱反应;
(3)根据化合价升降总数相等以及原子守恒来配平;
(4)根据铜元素守恒建立关系式:Cu~CuAlO2来计算;根据铝元素守恒建立关系式:Al2(SO4)3~2CuAlO2来计算;
(5)可溶性溶质从溶液中析出可用晶体的方法.
解答 解:由工艺流程图可知,废料在空气中熔炼时,Cu被氧化,滤渣中含有CuO及少量Ag,向滤渣中加入硫酸进行酸浸,CuO与硫酸反应,过滤得到硫酸铜溶液(含有硫酸),滤渣A为Ag;向滤液中加入硫酸铝、氢氧化钠,得到氢氧化铝、氢氧化铜,灼烧中会得到CuO、Al2O3,二者反应得到CuAlO2,
(1)无色的NO在常温下与空气中的O2迅速化合生成红棕色N02,发生2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
(2)未煮沸之前是Cu(OH)2和Al(OH)3,Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃,煮沸后Cu(OH)2分解产生氧化铜,可知B为Al(OH)3和CuO,氢氧化铝显两性能与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3和CuO;Al(OH)3+OH-=AlO2-+2H2O;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3=4CuAlO2+O2↑,故答案为:4;2;4;O2;
(4)由关系式:Cu~CuAlO2得n(CuAlO2)=$\frac{5.0×1000×63.5%}{63.5}$mol=50.0mol,则CuAlO2为50.0mol,由关系式:Al2(SO4)3~2CuAlO2得Al2(SO4)3=n(CuAlO2)×$\frac{1}{2}$=25.0mol,所以需要体积为$\frac{25.0mol}{1.0mol/L}$=25.0L,
故答案为:50.0;25.0;
(5)由CuSO4溶液获得CuSO4•5H2O晶体,需要经过蒸发浓缩,冷却结晶(或结晶),过滤等操作,故答案为:蒸发浓缩、冷却结晶.
点评 本题以从废料中回收银并制备铜化工产品为背景,考查了电解原理、沉淀的判断、氧化还原反应的配平以及化学计算,为高频考点,注意把握物质的性质以及题给信息,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 和间苯二胺
和间苯二胺 在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式:
在一定条件下以等物质的量缩聚而成.写出Nomex纤维的结构简式: .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(1)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
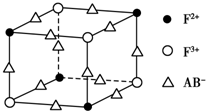 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在氧气中燃烧 | |
| B. | 氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体混合 | |
| C. | 锌与稀硫酸反应 | |
| D. | 氢氧化钡溶液与硫酸氢钠溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清溶液中:AlO2-、SO42-、Na+、HCO3- | |
| B. | 在由水电离出的c(OH-)=10-13 mol•L-1的溶液中:I-、K+、Cl-、Ba2+ | |
| C. | 滴加甲基橙显红色的溶液:Fe2+、NH4+、SO42-、NO3- | |
| D. | c(H+)=c(OH-)的溶液:Fe3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 200 | 300 | 400 |
| 气体体积/Ml | 224 | 280 | 280 |
| 剩余固体/mg | 14 | 67.5 | 167.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,
取一定浓度的NaOH溶液,通入一定量的CO2气体后,再逐滴加入0.1mol/L的盐酸,产生的CO2气体体积(标准状况)与所加入盐酸的体积之间的关系如图所示,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com