
| A. | 40% | B. | 60% | C. | 30% | D. | 50% |
分析 根据碳酸钙高温分解生成了氧化钙和二氧化碳剩余物中不含有碳元素,再根据碳酸钙中钙元素与碳元素的质量比与剩余固体中钙元素与碳元素的质量比可知已分解的碳酸钙占原碳酸钙的质量分数.
解答 解:由于碳酸钙高温分解生成了氧化钙和二氧化碳,随着碳酸钙的分解放出了二氧化碳,碳元素的含量逐渐减少直到为零.由题意可知,设分解的碳酸钙物质的量为X,未分解的为Y,剩余固体中钙元素的物质的量为X+Y,碳元素的物质的量为Y,测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3,即钙元素与碳元素的物质的量比为$\frac{\frac{20}{40}}{\frac{3}{12}}$=2,所以(X+Y):Y=2:1,得X=Y,所以已分解的碳酸钙与原碳酸钙的质量比是100X:100(X+Y)=1:2,即质量分数为50%,故选D.
点评 解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收空气中CO2 所致 | |
| B. | NaOH与玻璃作用,而后吸收CO2 所致 | |
| C. | NaOH中含有Na2CO3 | |
| D. | 溶液中的水分部分蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 简单离子半径:W>Y>Z | |
| B. | X与Y可形成既含极性键又含非极性键的化合物 | |
| C. | Z与W形成的化合物一定是离子化合物 | |
| D. | Y的氧化物对应的水化物的酸性一定比W的弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3、H2SO3、SO3、SO2 | B. | SO2 、H2SO3、Na2SO3 | ||
| C. | H2SO4、SO2 、Na2SO3 | D. | Na2SO3、SO2 、H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
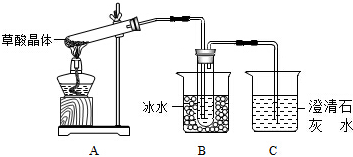
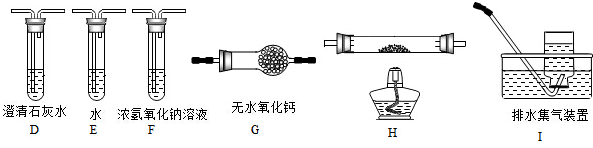
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com