
【题目】化学与生产、生活密切相关。下列说法错误的是( )
A.食用油和白酒都应密封保存
B.高温下铝粉和氧化铁的反应可以用来焊接铁轨
C.电影放映时射到银幕上的光柱证明存在气溶胶
D.钢铁锈蚀、食物腐败、钟乳石的形成均涉及氧化还原反应
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的离子方程式:
①硫酸和氢氧化钠溶液反应___;
②少量二氧化碳通入澄清石灰水___;
③碳酸钙和盐酸反应___;
④氯化钠和硝酸银反应___。
(2)写出符合下列离子反应的化学方程式:
①CO32-+Ba2+=BaCO3↓___;
②Cu2++Fe=Cu+Fe2+___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是

A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3 + H2SO4(浓)![]() NaHSO4 + HNO3↑
NaHSO4 + HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如图所示:
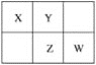
其中Z元素的原子序数是其最外层电子数的3倍。下列叙述中正确的是( )
A.元素Z位于第三周期ⅣA族
B.元素Y的原子序数为15
C.元素X最外层有6个电子
D.元素W最高价氧化物为WO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表与元素周期律在学习、研究和生产实践中都有非常重要的作用。下表(元素周期表前三周期的一部分)列出了①~⑦七种元素在周期表中的位置。
① | ② | ③ | |||
④ | ⑤ | ⑥ | ⑦ |
请回答:
(1)②所代表元素的名称为______
(2)七种元素中,非金属性最强的元素是______(填元素符号),最高价氧化物的水化物酸性最强的是_______(填化学式),最高正化合价与最低负化合价的代数和为4的元素是_______(填元素符号)。
(3)②、④、⑥所对应元素中原子半径最小的是______(填元素符号),简单离子半径最大的是______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,在100mL0.1mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化和H2S的挥发)。下列说法正确的是( )
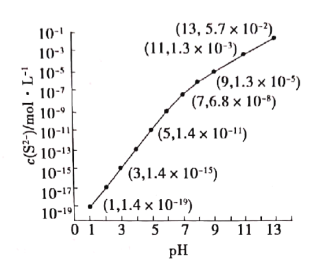
A.当c(H2S)+c(HS-)=0.043mol·L-1时,pH=13
B.pH=1时,c(H+)=c(Cl-)+c(HS-)+ c(S2-)+c(OH-)
C.向该溶液中加入NaOH固体至中性时c(Na+)>c(HS-)>c(S2-)>c(H+)=c(OH-)
D.已知:Ksp(MnS)=2.8×10-13,某溶液含amol·L-1Mn2+、0.10mol·L-1H2S,当溶液pH=5时,Mn2+开始沉淀,则a=0.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日,某科研团队成功合成了Ni—Fe双原子催化剂(Ni/Fe—C—N),并应用于高效催化CO2还原。回答下列问题:
(1)基态铁原子的价电子轨道排布图为__。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+__Fe3+(填“>”或“<”),原因是__。
(2)C、N、O三种元素的第一电离能由大到小的顺序为__。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与CO提供配位的电子总数之和为18,则n=___;该化合物易溶于苯及四氯化碳等有机溶剂,原因是___。
(4)二茂铁的结构为![]() ,由Fe2+和
,由Fe2+和![]() (环戊二烯基负离子)构成。一个
(环戊二烯基负离子)构成。一个![]() 中σ键总数为__,C原子的杂化轨道类型为__。
中σ键总数为__,C原子的杂化轨道类型为__。
(5)某C、Fe合金的晶胞结构如图所示:
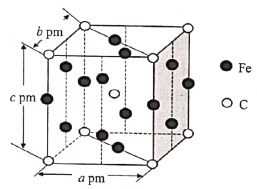
该合金的化学式为__,若该晶体的晶胞参数为apm、bpm、cpm,α=β=γ=90o,密度为ρg·cm-3,则NA为__(写出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的钠投入到24.6 g水中,反应后得到氢氧化钠溶液31.2 g。
(1)所得氢氧化钠溶液中溶质的物质的量为__________。
(2)参加反应钠的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K,1.01×105Pa条件下:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
O2(g)=CO2(g) △H=-282.9kJ·mol-1则该条件下CO(g)+H2O(g) = H2(g)+CO2(g)的反应热是
A. - 41.1 kJ·mol-1B. + 200.7 kJ·mol-1
C. - 766.5 kJ·mol-1D. + 41.1 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com