
【题目】利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验中模拟上述过程,其设计的模拟装置如下:
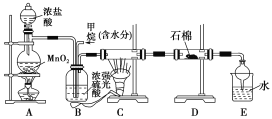
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是_________________。
(4)E装置的作用是________(填编号)。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式_________________________________________________。
【答案】干燥混合气体 大于或等于4 吸收过量的氯气 CD CH4+2Cl2![]() C+4HCl
C+4HCl
【解析】
实验室用浓盐酸和二氧化锰在加热条件下发生反应生成Cl2,Cl2经干燥后和甲烷在光照条件下发生取代反应,生成多种氯代甲烷和HCl,在强光照射下生成的黑色小颗粒为炭黑,发生的反应为CH4+2Cl2![]() C+4HCl,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
C+4HCl,最后生成的HCl溶于水生成盐酸,与有机物可用分液的方法分离;
(1)浓硫酸可以干燥氯气和甲烷;
(2)甲烷可以和氯气发生取代反应,产物为氯化氢和一氯甲烷、二氯甲烷、三氯甲烷和四氯化碳;
(3)氯气能将碘化钾氧化为碘单质;
(4)装置中生成的氯化氢气体用水吸收获得盐酸,氯化氢极易溶于水需要防止倒吸;
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒为炭黑,说明有碳生成。
(1)生成的氯气中含有水,B装置除具有控制气流速度、均匀混合气体之外,因浓硫酸具有吸水性,还具有干燥混合气的作用;
(2)氯气与甲烷发生取代反应,反应特点是1mol氯气可取代1molH原子生成1molHCl,设![]() =x,若理论上欲获得最多的氯化氢,即使CH4中H原子被完全取代,则x应大于或等于4;
=x,若理论上欲获得最多的氯化氢,即使CH4中H原子被完全取代,则x应大于或等于4;
(3)氯气具有氧化性,KI中-1价的碘能被氯气氧化,产物为氯化钾固体和碘单质,所以,D装置的石棉中均匀混有KI粉末,能吸收过量的氯气;
(4)装置中生成的氯化氢气体用水吸收获得盐酸,氯化氢极易溶于水需要防止倒吸,故答案为CD;
(5)CH4与Cl2在强光照射下生成的黑色小颗粒为炭黑,所以在强光照射下发生置换反应的方程式为CH4+2Cl2 ![]() C+4HCl。
C+4HCl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】化合物F是一种食品保鲜剂,可按如下途径合成:
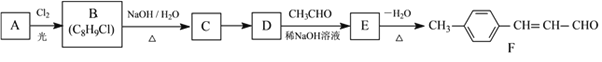 已知:RCHO+CH3CHO
已知:RCHO+CH3CHO![]() RCH(OH)CH2CHO。
RCH(OH)CH2CHO。
试回答:
(1)A的化学名称是____,A→B的反应类型是____。
(2)B→C反应的化学方程式为________。
(3)C→D所用试剂和反应条件分别是_____。
(4)E的结构简式是_____。F中官能团的名称是_____。
(5)连在双键碳上的羟基不稳定,会转化为羰基,则D的同分异构体中,只有一个环的芳香族化合物有____种。
其中苯环上只有一个取代基,核磁共振氢谱有5个峰,峰面积比为2∶1∶2∶2∶1的同分异构体的结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述不正确的是( )
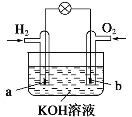
A.a极是负极,该电极上发生氧化反应
B.总反应方程式为2H2+O2═2H2O
C.b极反应是O2+4OH--4e-═2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子组成表示为CxHy的烷、烯、炔烃说法不正确的是( )
A.当x≤4时,常温、常压下均为气体
B.y一定是偶数
C.分别燃烧1 mol,耗氧气为(x+![]() )mol
)mol
D.在密闭容器中完全燃烧,150℃时测得的压强一定比燃烧前压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为不同化学元素组成的化合物示意图,以下说法不正确的是 ( )
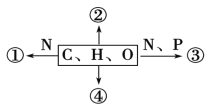
A. 若①为某种具有催化作用的化合物,则①的初步水解产物为多肽,彻底水解产物为氨基酸
B. 若②大量积累于皮下和内脏器官周围,则②为脂肪
C. 若③为构成细胞膜基本骨架的分子,则③为磷脂
D. 若④在低血糖时分解以补充血糖,则④可能是肌糖原和肝糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的物质不断变化,数10亿年来大气的成分也发生了很大的变化。下表是原始大气和目前空气的主要成分:
目前空气的成分 | N2、O2、CO2、水蒸气及稀有气体(如He、Ne等) |
原始氮气的主要成分 | CH4、NH3、CO、CO2等 |
用上表所涉及的分子填写下列空白。
(1)含有10个电子的分子有(填化学式,下同)______________________;
(2)由极性键构成的非极性分子有____________________;
(3)与H+可直接形成配位键的分子有________;
(4)沸点最高的物质是________,用所学的知识解释其沸点最高的原因_____________;
(5)分子中不含孤电子对的分子(稀有气体除外)有________,它的立体构型为________;
(6)极易溶于水、且水溶液呈碱性的物质的分子是________,它之所以极易溶于水是因为它的分子和水分子之间形成________;
(7)CO的结构可表示为O![]() C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
C,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以 Fe 和 Cu 为电极,稀 H2SO4 为电解质溶液形成的原电池中:
①H+向______极移动(填“正”或“负”)。
②电子流动方向由_____极流向______极(填:“正”、“负”)。
③若有 1mol e- 流过导线,则理论上负极质量减少______g。
④若将稀硫酸换成浓硝酸,负极电极方程式为:___________。
(2)甲烷燃料电池是一种高效无污染的清洁电池,它用 KOH 做电解质。则负极反应方程式是________。
(3)一定温度下,在容积为 2L 的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为 a∶b∶c=____。
②1 min 到 3 min 这段时刻,以 M 的浓度变化表示的平均反应速率为:______。
③下列叙述中能说明上述反应达到平衡状态的是_____。
A 反应中当 M 与 N 的物质的量相等时
B P 的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗 a mol N,同时消耗 b mol M
E 混合气体的压强不随时间的变化而变化F.M 的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的实验装置中,盛有足量水的水槽里放两个烧杯,小烧杯里放有适量铜片和过量硝酸,小烧杯外面倒扣一大烧杯,请回答下列问题:
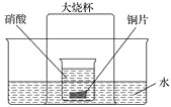
(1)实验过程中,观察到的主要现象是:
①____________________;
②_____________;
③________________;
④_____________________。
(2)用该装置做铜与浓硝酸反应的实验,最突出的特点是:_____________________。
(3)若要验证最终得到的气体生成物,最简便的方法是_______________。
(4)工业上吸收NO和NO2的混合气体,常使用NaOH溶液(NO+NO2+2NaOH===2NaNO2+H2O)。欲使NO和NO2被充分吸收,则NO和NO2的体积应满足________。
A V(NO)>V(NO2)
B V(NO)<V(NO2)
C V(NO)≤V(NO2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com