
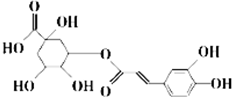
 中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )
中成药银翘中含有具有较广泛抗菌作用的有效成分--绿原酸,其结构简式如图所示.下列有关说法不正确的是( )| A. | 绿原酸可通过酯化反应人工合成 | |
| B. | 1 mol绿原酸能与2molBr2发生加成反应 | |
| C. | 1mol绿原酸能与6molNa发生置换反应 | |
| D. | 绿原酸能与NaHCO3溶液发生复分解反应 |
分析 该有机物含有酚羟基,可发生取代、氧化反应,含有羧基,具有酸性可发生中和、取代反应,含有酯基,可发生水解反应,含有羟基,可发生取代、消去、氧化反应,含有碳碳双键,可发生加成、氧化反应,以此解答该题.
解答 解:A.有机物含有酯基,可通过酯化反应生成,故A正确;
B.有机物含有酚羟基,苯环的氢原子都可被取代,含有碳碳双键,可与溴发生加成反应,则1 mol绿原酸能与4molBr2发生加成反应,故B错误;
C.含有5个羟基、1个羧基,则1mol绿原酸能与6molNa发生置换反应,故C正确;
D.含有羧基,酸性比碳酸强,则绿原酸能与NaHCO3溶液发生复分解反应,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物官能团的性质,易错点为B,注意溴与苯环的取代反应.


科目:高中化学 来源: 题型:选择题
| A. | NaOH和H2 | B. | Cu(OH)2、NaCl和H2 | C. | Cu和NaCl | D. | NaCl、Cu(OH)2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,8gO2含有4nA个电子 | |
| B. | 标准状况下22.4 L的NH3溶于水,所得溶液中有nA个NH4+ | |
| C. | 200mL的5mol•L-1盐酸中含有nA个HCl分子 | |
| D. | 1mol Na被完全氧化生成Na2O2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
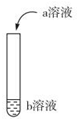 如图进行实验,向试管中的b溶液中加入少量a溶液,试管中现象对应的离子方程式正确的是( ))
如图进行实验,向试管中的b溶液中加入少量a溶液,试管中现象对应的离子方程式正确的是( ))| 选项 | a | b | 试管中现象 | 离子方程式 |
| A | 稀H2SO4 | KI淀粉 | 在空气中放置一段时间后溶液呈黄色 | 4I-+O2+2H2O=2I2+4OH- |
| B | Na2CO3 | 稀盐酸 | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3-; HCO3-+H+=H2O+CO2↑ |
| C | 稀盐酸 | Na2SiO3 | 产生白色胶状物 | 2H++SiO32-=H2SiO3(胶体) |
| D | 稀H2SO4 | 滴有酚酞的Ba(OH)2 | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-= BaSO4↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
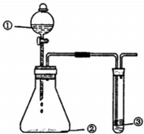 用如图所示装置进行下列实验,有关分析一定不正确的是
用如图所示装置进行下列实验,有关分析一定不正确的是| 选項 | ① | ② | ③ | 预期现象或结论 |
| A | 稀H2SO4 | Na2SO3 | 澄清石灰水 | 滴入少量稀H2SO4时③中立即出现浑浊 |
| B | H2O2溶液 | FeCl3 | FeCl2溶液 | FeCl3作催化剂 |
| C | 盐酸 | KMnO4 | 淀粉KI溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 浓 HNO3 | Cu粉 | 石蕊溶液 | ③中可能先变后褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2 中少量CO,通过灼热氧化铜 | |
| B. | 除去NO中少量NO2,气体通入足量水中后,用浓硫酸干燥 | |
| C. | 除去KCl固体中少量K2CO3,加入足量盐酸后,蒸发、结晶 | |
| D. | 除去CuSO4 溶液中Fe2(SO4)3 杂质,加入足量铜粉,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3(s)═MgO(s)+CO2(g)△H=+1.366 kJ/mol | |
| B. | MgCO3(s)═MgO(s)+CO2(g)△H=-1.366 kJ/mol | |
| C. | MgCO3(s)═MgO(s)+CO2(g)△H=-114.7 kJ/mol | |
| D. | MgCO3(s)═MgO(s)+CO2(g)△H=+114.7 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com