
水的电离平衡曲线如下图所示。下列说法正确的是( )
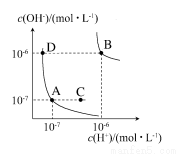
A.图中对应点的温度关系为A>B
B.水的电离常数KW数值大小关系为B>D
C.温度不变,加入少量NaOH可使溶液从C点变到A点
D.在B点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显酸性
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 9-2 食品中的有机化合物练习卷(解析版) 题型:选择题
下列说法中,不正确的是( )
A.石油的分馏主要是物理变化而煤的干馏主要是化学变化
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.淀粉、纤维素的分子式都可表示为(C6H10O5)n,二者互为同分异构体
D.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-3 盐类的水解练习卷(解析版) 题型:选择题
25℃时,某浓度的氯化铵溶液的pH=4,下列叙述中不正确的是( )
A.溶液中的c(OH-)=1×10-10 mol·L-1
B.溶液中的c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.溶液中的c(H+)+c(NH4+)=c(Cl-)+c(OH-)
D.溶液中的c(NH3·H2O)=c(NH4+)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
能促进水的电离,并使溶液中c(H+)>c(OH-)的操作是( )
①将水加热煮沸 ②向水中投入一小块金属钠 ③向水中通CO2 ④向水中加入NH4Cl固体 ⑤向水中加入NaHCO3固体 ⑥向水中加入NaHSO4固体
A.①②⑤ B.①④ C.③④⑥ D.④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-2 溶液的酸碱性练习卷(解析版) 题型:选择题
25℃时,水中存在电离平衡:H2O H++OH-。下列关于水的说法,不正确的是 ( )
H++OH-。下列关于水的说法,不正确的是 ( )
A.水的电离是吸热过程
B.向水中加入少量稀硫酸,c(H+)增大,KW不变
C.含H+的溶液显酸性,含OH-的溶液显碱性
D.水是极弱的电解质,在50℃时水的pH小于7
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 8-1 弱电解质的电离平衡练习卷(解析版) 题型:选择题
对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A.AlCl3溶液中再溶入AlCl3
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体
D.醋酸溶液加热
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-3 化学平衡的移动练习卷(解析版) 题型:填空题
在一密闭恒容的容器中,可逆反应3A(g) 3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
3B(?)+C(?)的能量变化如图甲所示,气体的平均相对分子质量随时间的变化如图乙所示。
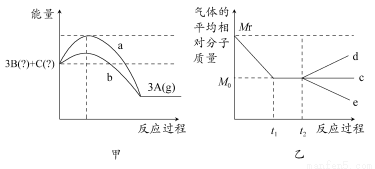
(1)由图甲可以判断3A(g) 3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
3B(?)+C(?)的正反应是________反应(填“吸热”或“放热”),实验a和实验b相比较,可能隐含的反应条件是________。
(2)由图乙可以得出有关B和C状态的结论是________。
①若t2时刻升高温度,气体的平均相对分子质量变化一定符合________线(填“c”“d”或“e”)。
②若改变压强,气体的平均相对分子质量变化一定符合c线,则C物质的状态为________。
(3)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是________状态,C是________状态。
(4)如果B为气体,C为固体,取0.3 mol A恒温下在1 L容器中充分反应,平衡时测得B的浓度为0.21 mol/L。若使反应从逆反应开始,起始时在容器中加入0.3 mol B,同样条件下,要使平衡时B的浓度仍为0.21 mol/L,则C的物质的量的取值范围应该是________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:填空题
在一个体积为1 L的密闭容器中发生某化学反应:2A(g) B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800°C,实验Ⅲ在850°C,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示。
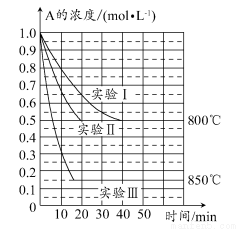
试回答下列问题:
(1)在实验Ⅰ中,反应在20~40 min内A的平均反应速率为________mol·L-1·min-1。实验Ⅱ和实验Ⅰ相比,可能隐含的反应条件是________________。
(2)该反应的ΔH________0,其判断理由是________。
(3)实验Ⅰ第40 min末,若降低反应温度,达到新的平衡后,A的浓度不可能为________(填序号)。
A.0.35 mol·L-1 B.0.4 mol·L-1 C.0.7 mol·L-1 D.0.8 mol·L-1
(4)若反应在800°C进行,在该1 L的密闭容器中加入1 mol A、0.2 mol He,达到平衡时A的转化率应________。
A.等于86% B.等于50%
C.小于50% D.介于50%~86%之间
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:选择题
用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是( )
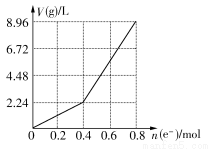
A.电解前CuSO4溶液的物质的量浓度为2 mol/L
B.电解后所得溶液中c(H+)=2 mol/L
C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3
D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com