
【题目】某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
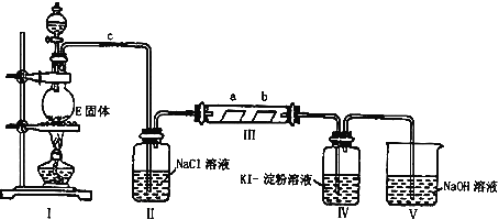
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是___。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)装置Ⅱ中饱和食盐水的作用是___。
(3)实验室以二氧化锰和浓盐酸制备氯气的离子方程式为:___。
(4)实验过程中,装置IV中的实验现象为__;发生反应的化学方程式为__。
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加如图中的__装置![]() 填序号
填序号![]() ,该装置的作用是__。
,该装置的作用是__。

(6)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式__。
【答案】AD 除去Cl2中的HCl气体 MnO2+4H+ +2Cl-![]() Mn2+ +Cl2↑+2H2O 无色溶液变蓝色 Cl2+2KI=I2+2KCl ④ 干燥Cl2 Cl2+2OH-=Cl-+ClO-+H2O
Mn2+ +Cl2↑+2H2O 无色溶液变蓝色 Cl2+2KI=I2+2KCl ④ 干燥Cl2 Cl2+2OH-=Cl-+ClO-+H2O
【解析】
(1)依据氯气是黄绿色气体、氯水中溶有氯气、氯离子和银离子生成氯化银沉淀解答;
(2)依据饱和食盐水可除去氯气中的氯化氢解答;
(3)依据二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水解答;
(4)依据氯气置换出碘化钾中的碘单质,碘单质遇到淀粉变蓝解答;
(5)依据用浓硫酸干燥氯气解答;
(6)依据氢氧化钠和氯气反应生成氯化钠、次氯酸钠和水解答;
(1)A.氯水中含有Cl2,氯气是浅黄绿色气体,A项正确;
B.Cl的化合价为氯元素的最低价,只具有还原性,Cl2具有很强的氧化性,B项错误;
C.新制氯水可以用来杀菌消毒是因为生成次氯酸具有氧化性,和强酸无关,C项错误;
D.将新制氯水滴入AgNO3溶液,氯气和水反应生成的盐酸中的氯离子结合银离子生成白色沉淀,D项正确;
故答案为:AD;
(2)装置Ⅱ中饱和食盐水的作用是除去氯气中的氯化氢气体,
故答案为:除去Cl2中的HCl气体;
(3)实验室以二氧化锰和浓盐酸加热反应生成氯气,发生反应的离子方程式为:![]() ;
;
(4)实验过程中,有氯气通过装置IV中,氯气置换出碘化钾中的碘单质,反应的方程式为Cl2+2KI=I2+2KCl,反应生成的碘单质遇到淀粉变蓝。
故答案为:无色溶液变蓝色;Cl2+2KI=I2+2KCl;
(5)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象是因为制取的氯气没有干燥,因此应该还需在图中装置Ⅱ与Ⅲ之间添加浓硫酸做干燥装置,作用是干燥氯气,
故答案为:④;干燥Cl2;
(6)装置Ⅴ的目的是用氢氧化钠吸收剩余的氯气,防止尾气污染,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的反应X+3Y![]() 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度为c(X)=c(Y)=0.100molL-1、c(Z)=0molL-1,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
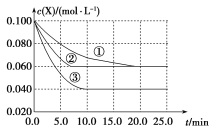
A.反应0~5.0min实验③的反应速率最快B.条件②的反应最先达到平衡
C.②与①比较,②可能压强更大D.该反应的正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X(g)+Y(g)![]() 2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
2Z(g),反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是( )
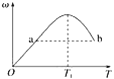
A. T1时,v正>v逆
B. 正反应的ΔH<0
C. a、b两点的反应速率v(a)=v(b)
D. 当温度低于T1时,ω增大的原因是平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在下列事实中,影响化学反应速率的因素分别为:
(1)夏天将食物存放在电冰箱里___;
(2)钠可以与冷水剧烈反应,铝与水反应必须加热____;
(3)工业制氨需要高压____。
Ⅱ.向体积为2L的恒容密闭容器中充入1molN2和3molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
2NH3(g),达到平衡时,N2的转化率为20%,回答下列问题:
(1)平衡时,c(N2):c(H2)=___,平衡转化率α(N2):α(H2)=___;
(2)设平衡时压强为P平,反应开始时压强为P始,则P平:P始=___;
(3)若起始投料改为只加入2molNH3,则相同条件达到平衡时NH3的转化率为α(NH3)=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.苯和甲苯都能使酸性KMnO4溶液褪色
B.饱和溴水滴入苯酚的稀溶液中,生成白色沉淀
C.乙醛与新制Cu(OH)2悬浊液共热能生成砖红色沉淀
D.乙酸能与NaHCO3溶液反应生成无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验安全下列说法正确的是
A.用排水法收集氧气时,先熄灭酒精灯,再把导气管从水槽中取出
B.在贴有此标志 的地方,禁止吸烟
的地方,禁止吸烟
C.浓硫酸不小心沾在皮肤,先用大量水冲洗,再涂上3﹪~5﹪的烧碱溶液
D.氢气点燃不会发生爆炸,所以在点燃前不需要验纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿可以制成太阳能电池、发光二极管和催化剂,甚至可以制成未来量子计算机的元件。钙钛矿并不是专指某种含钙和钛的化合物,而是一类具有ABX3组成的晶体材料的总称,其中A和B是阳离子,X是阴离子。
(1)历史上所发现的第一种钙钛矿,是天然矿物钛酸钙(CaTiO3),其中Ti4 +的核外电子排布式为____;钛酸钙中两种阳离子中半径较大的是__。
(2)一种有机卤化铅钙钛矿是由[CH (NH2)2]+、Pb2+和Cl-构成的,这种钙钛矿的化学式为___,在[CH(NH2)2]+中碳原子的杂化方式为____。
(3)2018年我国科学家制得世界首例无金属钙钛矿材料。下列有机阳离子均可用于制备无金属钙钛矿:
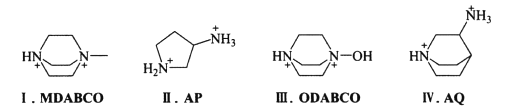
其中含有手性碳原子的是____(填序号)。
(4)如图是CaTiO3的两种晶胞结构示意图,两种晶胞的参数均为a=b=c=379. 5 pm,α=β=γ=90°;
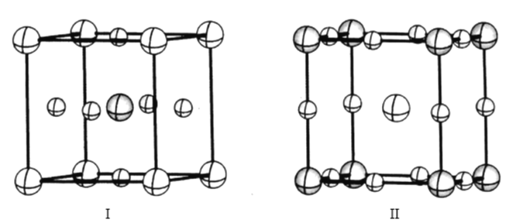
在晶胞I中氧离子占据的是___(填“体心”“面心”或“顶点”),在晶胞II中氧离子之间最近的距离是___pm(列出计算表达式)。
(5)无金属钙钛矿MDABCO—NH4 I3的晶胞类型与CaTiO3相同。若在MDABCO-NH4I3的晶胞中NH4+的分数坐标为(![]() ,
,![]() ,
,![]() ),其中一种I-的分数坐标为(0,0,
),其中一种I-的分数坐标为(0,0,![]() ),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
),则MDABCO的分数坐标为___。与MDABCO 距离最近的I-的个数为____个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com