
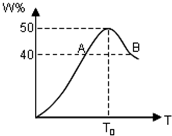
 2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:
2L容器中,分别将物质的量均为2.00mol的X、Y混合,在不同温度(T)下发生如下反应:2X(g)+Y(g)?2W(g).并在第10s时分别测定其中W的体积分数(W%),并绘成如图所示曲线:. |
| v |
| 2x |
| 2-2x+(2-x)+2x |
| △C |
| △t |
| 0.8mol/2L |
| 10s |
| 2x |
| 2-2x+(2-x)+2x |
| 2 |
| 3 |
| 4 |
| 3 |
| ||
| 2 |


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
| A、用洗气瓶中的NaOH溶液除去CO2中混有的HCl气体 |
| B、在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
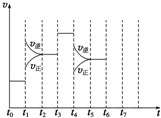 在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:
在一密闭容器中发生反应N2+3H2?2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO与H2的混合气体 |
| B、CH3CH2OH |
| C、HCOOH |
| D、CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
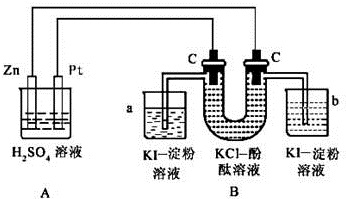
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在HCl |
| B、一定存在SO2 |
| C、肯定没有CO2 |
| D、不能肯定是否含有NO2、HI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO3>I->Fe2+>NO |
| B、I->Fe2+>H2SO3>NO |
| C、Fe2+>I->H2SO3>NO |
| D、NO>Fe2+>I->H2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用SO2漂白纸浆和草帽辫 |
| B、用硫酸清洗锅炉中的水垢 |
| C、高温下用焦炭还原SiO2制取粗硅 |
| D、用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com