
有一固体混合物X,可能含有氯化钠、碳酸钾、亚硝酸钠、硫酸铝、碱式碳酸镁、碳酸氢钠等物质。为探究X的成分,设计方案并进行了如下实验:
Ⅰ.将X粉末充分加热,有气体产生。
Ⅱ.取一定量X粉末,加入足量的蒸馏水,粉末全部溶解,得到无色溶液。
Ⅲ.用铂丝蘸取少量Ⅱ中所得溶液,在火焰上灼烧,产生黄色火焰;透过蓝色钴玻璃观察,无紫色火焰。
Ⅳ.取Ⅱ中无色溶液,滴入KMnO4酸性溶液,紫红色不褪去。
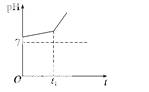
Ⅴ.取Ⅱ中溶液,用惰性电极电解,开始时阳极产生的气体能使湿润的淀粉碘化钾试纸变蓝色。电解过程中测得溶液pH变化如右图所示。
(1)根据实验Ⅳ可判断,一定不存在的物质是__________。
(2)X的成分是________(填化学式)。
(3)实验Ⅴ中,0→t1时间内,两个电极上的电极反应式为
阳极:__________ _____________________________________________________;
_____________________________________________________;
阴极:________________ _____________________________________________。
_____________________________________________。
(4)0→t1时间内,溶液pH升高比较缓慢的原因是_______________________(用离子方程式表示)。
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
下列反应中,属于取代反应的是( )
①CH3CH=CH2+Br2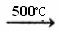 CH2BrCH=CH2+HBr
CH2BrCH=CH2+HBr
②CH3CH2Br+NaOH CH2=CH2↑+H2O+NaBr
CH2=CH2↑+H2O+NaBr
③CH3COOCH2CH3+H2O 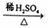 CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
④C6H5OH+3H2 C6H11OH
C6H11OH
A.①② B.③④ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中的反应,属于同一反应类型的是( )
A.乙烯水化制乙醇;乙烷光照条件下制取溴乙烷
B.甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷
C.甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯
D.由苯制溴苯;由乙酸与乙醇反应制乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下列各物质间的转化图,仔细分析后回答各题。
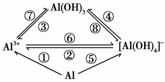
(1)图中属于氧化还原反应的有________个。
(2)若实现图中①②③④各反应的转化,可加入相同的试剂,其名称为________;试写出反应②的离子方程式:____________________________。
若实现图中⑤⑥⑧各转化反应,可加入相同的试剂,其名称为____________;氢氧化铝的用途很多,试写出实验室用反应⑦制取氢氧化铝的离子方程式:________________ ___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.铁的应用经历了“铁—普通钢—不锈钢等特种钢”的演变过程
B.减少生铁里的碳元素,并增加硅、锰等元素,即转化为钢
C.普通钢中的含铬量一般在12%以上
D.不锈钢是在普通钢的基础上,加入铬、镍等多种元素炼成的钢材
查看答案和解析>>
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:_ ___________
___________
 ②设计实验方案:在不同H2O2浓度下,测定 ________________________
②设计实验方案:在不同H2O2浓度下,测定 ________________________ ____________(要求所测得的数据能直接体现反应速率大
____________(要求所测得的数据能直接体现反应速率大 小)。
小)。
③设计实验装置,完成图20的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的 数据;数据用字母表示)。
数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1mol·L-1Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
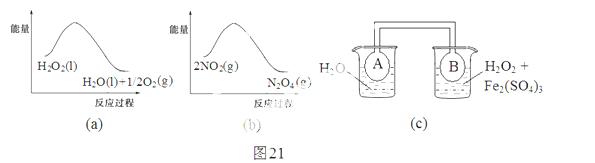
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中正确的是( )
A. 钠与水反应:2Na+2H2O=2Na++2OH﹣+H2↑
B. 氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42﹣=BaSO4↓
C. 硫化钠溶于水呈碱性:S2﹣+2H2O⇌H2S+2OH﹣
D. 向溴化亚铁溶液中通入少量氯气:Cl2+2Br﹣=2Cl﹣+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化氧化反应将SO2转化为SO3是工业上生产
硫酸的关键步骤.
(1)T1℃时,在1L密闭容器中充入0.6molSO3,图1表示SO3
物质的量随时间的变化曲线。
①平衡时,SO3的转化率为 (保留小数点后一位) ;
T1℃时,反应2SO2(g)+O2(g)  2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3
2SO3(g) 的平衡常数为 ;其他条件不变,在8min时压缩容器体积至0.5L,则n(SO3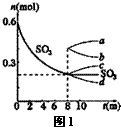 )的变化曲线为 (填字母)。
)的变化曲线为 (填字母)。
②下表为不同温度(T)下,反应2SO2(g)+O2(g)  2SO3(g) (△H<0)的化学平衡常数(K)
2SO3(g) (△H<0)的化学平衡常数(K)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
由此推知,温度最低的是 (填“T1”、“T2” 或 “T3”)。
③在温度为T1℃时,向该1L的密闭容器中同时加入0.2molSO2、xmolO2、0.2molSO3三种气体,在达到平衡前若要使SO3的浓度减小,则x的取值范围是 。
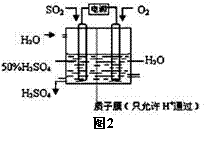
(2)科学家研究出用电化学原理生产硫酸的新工艺,装置如图2所示,总反应的化学方程式为 ,其阳极的电极反应式为
 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com