
��֪��(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ��H = + 74.9 kJ·mol-1������˵������ȷ���� �� ��
A���÷�Ӧ���ر䡢�ʱ�Դ���0
B���÷�Ӧ�����ȷ�Ӧ�����һ�������Է�����
C��̼���ηֽⷴӦ�������ӣ�����κ�����������̼���ηֽ�һ���Է�����
D�����Է����еķ�Ӧһ���Ƿ��ȷ�Ӧ�������Է����еķ�Ӧһ�������ȷ�Ӧ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��a g��ͭƬͶ��������һ��Ũ�ȵ�������Һ�У���Ӧ�����ĵ�HNO3Ϊb g����a��b��8��21����Ӧ�����������õ����������Ϊ(����)
A��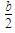 g
g
B��2b g
C��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A����ɫ��Һ�У�K����H+��Fe2+��NO3��
B��c��H+����c��OH��������Һ�У�Na+��K+��SO42����ClO��
C����0.1mol��L��1 HCO3������Һ�У�Al3+��Ca2+��NO3����SO42��
D����0.1 mol��L��1 SCN������Һ�У�Fe3����NH4����NO3����Cu2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CO�����ںϳɼ״���һ���¶��£������Ϊ2L���ܱ������м���CO��H2��������Ӧ
CO��g��+2H2��g�� CH3OH��g������ƽ����ø����Ũ�����£�
CH3OH��g������ƽ����ø����Ũ�����£�
| ���� | CO | H2 | CH3OH |
| Ũ��(mol•L��1) | 0.9 | 1.0 | 0.6 |
�ٻ�������ƽ����Է�������__________________________��
����ʽ������ƽ�ⳣ��K=__________________________��
�������������ѹ��Ϊ1L,�������㣬Ԥ����ƽ����c(H2)��ȡֵ��Χ��__________��
��������������䣬�ٳ���0.6molCO��0.4molCH3OH,��ʱv��___v��(�>������<����=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.1mol��L��CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
CH3COO��+H+ ���ڸ�ƽ�⣬����������ȷ���� �� ��
A����������NaOH���壬ƽ�����淴Ӧ�����ƶ�
B�������¶ȣ�ƽ��������Ӧ�����ƶ�
C������ˮϡ�ͣ���Һ��c(H+)һ������
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶�ʱ���͵�BaSO4��Һ�м�ˮ������������ȷ���� �� ��
A��BaSO4�ܽ������Ksp����
B��BaSO4�ܽ�ȡ�Ksp������
C��BaSO4�ܽ�Ȳ��䣬Ksp����
D��BaSO4�ܽ�ȡ�Ksp������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״���
( CO2 + 3H2 = CH3OH + H2O )����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�ء�
��֪ H2(g)�� CO(g) �� CH3OH(l) ��ȼ���ȡ�H�ֱ�Ϊ-285.8 kJ·mol-1��-283.0 kJ·mol-1��-726.5kJ·mol-1����ش��������⣺
(1)��̫���ֽܷ�10molˮ���ĵ�������_____________kJ
(2)���ݻ�Ϊ2L���ܱ������У���CO2��H2�ϳɼ״����������������������£������¶ȶԷ�Ӧ��Ӱ�죬ʵ������ͼ��ʾ��ע��T1��T2������300�棩������˵����ȷ����________������ţ�
 ���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
���¶�ΪT1ʱ���ӷ�Ӧ��ʼ��ƽ�⣬���ɼ״���
ƽ������Ϊv(CH3OH)=  mol·L-1·min-1
mol·L-1·min-1
�ڸ÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
�۸÷�ӦΪ���ȷ�Ӧ
�ܴ���A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ ����
����
(3)��T1�¶�ʱ����1molCO2��3molH2����һ�ܱպ��������У���ַ�Ӧ�ﵽƽ�����CO2ת����Ϊa,�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ ( �� a ��ʾ )
(4)��֪�״�ȼ�յĻ�ѧ����ʽΪ2CH3OH +3O2 =2CO2 +4H2O ����ֱ���Լ״�Ϊȼ�ϵ���У��������ҺΪ���ԣ������ķ�ӦʽΪ �������ķ�Ӧʽ
Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶�ʱ���͵�BaSO4��Һ�м�ˮ������������ȷ���� �� ��
A��BaSO4�ܽ������Ksp����
B��BaSO4�ܽ�ȡ�Ksp������
C��BaSO4�ܽ�Ȳ��䣬Ksp����
D��BaSO4�ܽ�ȡ�Ksp������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���з��ӽṹ�У�����ԭ�Ӳ��ܶ����������Ϊ8�����ȶ��ṹ����
A��CO2 B��H2O C��N2 B��CCl4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com