
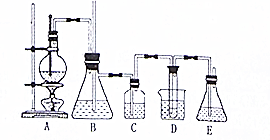
 实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:
实验室用乙醇和必要的无机试剂制取1,2一二溴乙烷的装置如图,1,2一二溴乙烷的部分性质如下表:| 常温下颜色状态 | 密度 | 熔点 | 沸点 | 溶解性 |
| 无色液体 | 2.18g/cm3 | 9.79℃ | 131.4℃ | 不溶于水、一溶于醇、醚、丙酮 |
分析 实验室制备1,2-二溴乙烷的反应原理为:A装置中乙醇发生消去反应生成乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,生成的乙烯中有酸性气体二氧化碳和二氧化硫,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去,
(1)乙醇和浓硫酸的混合液反应比较剧烈,要事先加入少量的碎瓷片(或沸石),防止暴沸;
(2)D中的导气管发生堵塞,会使B中的压强增大,将B中的水压入导管,使B中的水面下降,玻璃管中的水面上升甚至会溢出;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,有杂质气体;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,
(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发;
(6)由于溴有挥发性、有毒,故E为尾气处理装置;
(7)根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:实验室制备1,2-二溴乙烷的反应原理为:A装置中乙醇发生消去反应生成乙烯:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,B装置可以作安全瓶,要以防倒吸,由于有副反应的发生,生成的乙烯中有酸性气体二氧化碳和二氧化硫,所以C装置用氢氧化钠吸收乙烯中的酸性杂质气体,然后乙烯与溴发生加成反应生成1,2-二溴乙烷:CH2=CH2+Br2→BrCH2CH2Br,产物中混有的溴单质可以用氢氧化钠溶液除去,
(1)乙醇和浓硫酸的混合液反应比较剧烈,要事先加入少量的碎瓷片(或沸石),防止暴沸,
故答案为:碎瓷片(或沸石);
(2)D中的导气管发生堵塞,会使B中的压强增大,将B中的水压入导管,使B中的水面下降,玻璃管中的水面上升甚至会溢出,
故答案为:B中的水面下降,玻璃管中的水面上升甚至会溢出;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,用氢氧化钠溶液除去乙烯中混有的少量SO2、CO2,
故答案为:洗去乙烯中混有的少量SO2、CO2;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,观察到液体颜色变浅,
故答案为:液体颜色变浅;
(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故开始反应时向装置D的烧杯中加入冰水的作用为降温,防止液溴挥发,
故答案为:降温,防止液溴挥发;
(6)由于溴有挥发性、有毒,故E为尾气处理装置,吸收多余的Br2,防止污染环境,
故答案为:尾气处理,吸收多余的Br2,防止污染环境;
(7)根据反应方程式CH2=CH2+Br2→BrCH2CH2Br可知,46g乙醇可理论上制备乙烯1mol,与足量的溴反应,制备1,2-二溴乙烷的物质的量为1mol,质量为188g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{178.6}{188}$×100%=95%,
故答案为:95%.
点评 该题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,难度中等.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:解答题

 (R、R′可表示烃基或官能团)
(R、R′可表示烃基或官能团) .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是m个 | B. | 一定是n个 | C. | 一定是(m+n)个 | D. | 可能是(m+n)个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com