
 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ͼ�ɵó����ж���ȷ����
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ͼ�ɵó����ж���ȷ���� 
 Сѧ��ĩ���Ծ�ϵ�д�
Сѧ��ĩ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| 500-850�� |
| �����������Һ��ֱ�� | ��������ȫ�ѽ�����ʱ�� | |
| ��ͨ������ | 800-1200/��m | 10s���� |
| ��תʽ������ | 600-850 ��m | 8-10s |
| ѹ���������� | 400-650 ��m | 6-7s |
| ������������ | 100-300��m | 3.5-5s |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
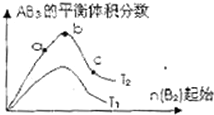 ij��ѧ����С���о���������������ʱ���ı�ijһ������A2��g��+3B2��g��?2AB2��g����ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ��������ݴ˿ɵó����жϽ��۲���ȷ���ǣ�������
ij��ѧ����С���о���������������ʱ���ı�ijһ������A2��g��+3B2��g��?2AB2��g����ѧƽ��״̬��Ӱ�죬�õ�����ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ��������ݴ˿ɵó����жϽ��۲���ȷ���ǣ�������| A���ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a | B��a��b��c�����ƽ�ⳣ����ͬ | C����T2��T1��������Ӧһ�������ȷ�Ӧ | D��b��ʱ��ƽ����ϵ��A��Bԭ����֮��һ����1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| C(H+) | C(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��0110 ������ ���ͣ�������ѡ����
 2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ͼ�ɵó����ж���ȷ����
2AB3(g)��ѧƽ��״̬��Ӱ�죬�õ���ͼ��ʾ�ı仯���ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���������ͼ�ɵó����ж���ȷ���� 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com