
实验室用锌粒与V mL浓度为10%的稀硫酸反应制取氢气,若向反应混合物中加入下列物质,关于反应速率v说法正确的是( )
A.少量Na2SO4固体,v(H2)减小
B.V mL BaCl2溶液,v(H2)不变
C.加入细小的碳粒,v(H2)增大
D.加入NH4HSO4固体,v(H2)不变
科目:高中化学 来源: 题型:
在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11。当氢氧化物开始沉淀时,下列离子中所需pH最小的是( )
A.Fe3+ B.Cr3+ C.Zn2+ D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下所示:
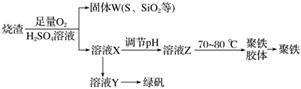
(1)验证固体W焙烧后产生的气体中含有SO2的方法是
________________________________________________________________________。
(2)制备绿矾时,向溶液X中加入过量__________,充分反应后,经__________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为________________________________________________________________________。
若溶液Z的pH偏小,将导致聚铁中铁的质量分数________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2 mol·L-1·min-1
B.6~10 min的平均反应速率:
v(H2O2)<3.3×10-2 mol·L-1·min-1
C.反应到6 min时,c(H2O2)=0.30 mol·L-1
D.反应到6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应过程中能量变化如图所示,下列有关叙述正确的是( )
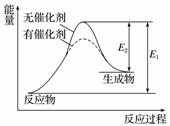
A.该反应为放热反应
B.催化剂改变了化学反应的热效应
C.催化剂不改变化学反应过程
D.催化剂改变了化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)2CO2(g)+N2(g) ΔH<0。已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的表中。
| 实验编号 | T(℃) | NO初始浓度(mol·L-1) | CO初始浓度(mol·L-1) | 催化剂的比表面积(m2·g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
(1)请填全表中的各空格;
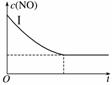
(2)实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如右图所示。请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L-1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是__________________________,
理由是________________________________________________________________________。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是________________________________________________________________________。
(3)丙分别取pH=3的盐酸和醋酸各10 mL,然后加入质量相同的锌粒,醋酸放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?________,请说明理由:_____________________________。
(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。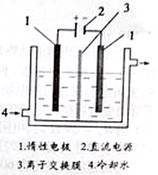 碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。图中的序号3应为 离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 。
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:
KI溶液、 、 ;反应的离子方程式为 。
(5)已知KI+I2 KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
KI3,将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适?______(填“是”或“否”),并说明理由_______________________________。为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是___________________。
A.Na2S2O3 B.AlCl3 C.Na2CO3 D.NaNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com