
| A、1 | B、2 | C、3 | D、4 |


科目:高中化学 来源: 题型:
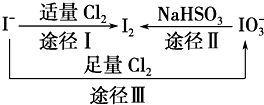 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| B、氢氧化钡溶液和硫酸铵溶液反应:Ba2++SO42-=BaSO4↓ |
| C、硫化钠溶于水呈碱性:S2-+2H2O?H2S+2OH- |
| D、向溴化亚铁溶液中通入少量氯气:Cl2+2Br-=2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、偏二甲肼的摩尔质量为60g |
| B、1 mol偏二甲肼的质量为60g/mol |
| C、6.02×1023个偏二甲肼分子的质量为60g |
| D、6 g偏二甲肼含有NA个偏二甲肼分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 同学甲 | 同学乙 | |
| 实验方案 |  | 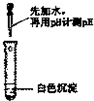 |
| 实验现象 | ||
| 实验结论 | 只有MgCO3 | 只有Mg(OH)2 |
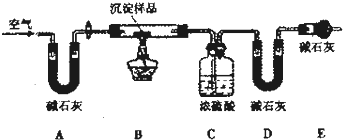
| 实验序号 | 沉淀样品质量 | CO2的物质质量/mol | H2O的物质的量/mol |
| 1 | 3.64 | 0.03 | 0.04 |
| 2 | 7.28 | 0.06 | 0.08 |
| 3 | 10.92 | 0.09 | 0.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
| W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中,W原子易失去最外层电子形成与Ne原子电子层结构相同的Wn+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)写出实验室制取氨气的化学方程式:
(1)写出实验室制取氨气的化学方程式:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com