
| HI������� | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| ����I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| ����II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
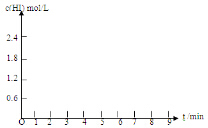
���� ��1���ɱ������ݿ�֪������I��5minʱ����ƽ��״̬����I2����Ũ��Ϊxmol/L����
I2��g��+H2��g��?2HI��g��
��ʼŨ�ȣ�mol/L����0.8 1.2 0
ת��Ũ�ȣ�mol/L����x x 2x
ƽ��Ũ�ȣ�mol/L����0.8-x 1.2-x 2x
����HI����������з��̼���x���ٸ���K=$\frac{{c}^{2}��HI��}{c��{I}_{2}����c��{H}_{2}��}$���㣻
��2������v=$\frac{��c}{��t}$���㣻
��3����ͬʱ����HI�����������С��˵����Ӧ���ʼ�����ƽ��ʱHI���������������Iʱ���ʸı�����ƽ�������ƶ�������ѹǿ��������Ӱ��ƽ���ƶ��������ǽ����¶ȣ�
��4�������¶�ƽ��ʱ�����ƶ���˵������ӦΪ���ȷ�Ӧ��
��5��������I�´ﵽƽ�����7minʱ���������ѹ��Ϊԭ����һ�룬ѹǿ����ƽ�ⲻ�ƶ���HI��Ũ�ȱ�Ϊԭƽ���2����
��� �⣺��1���ɱ������ݿ�֪������I��5minʱ����ƽ��״̬����I2����Ũ��Ϊxmol/L����
I2��g��+H2��g��?2HI��g��
��ʼŨ�ȣ�mol/L����0.8 1.2 0
ת��Ũ�ȣ�mol/L����x x 2x
ƽ��Ũ�ȣ�mol/L����0.8-x 1.2-x 2x
HI���������Ϊ60%����$\frac{2x}{2}$=60%����x=0.6��ƽ�ⳣ��K=$\frac{{c}^{2}��HI��}{c��{I}_{2}����c��{H}_{2}��}$=$\frac{1��{2}^{2}}{0.2��0.6}$=12��
�ʴ�Ϊ��12��
��2��������I�ӿ�ʼ��Ӧ������ƽ��ʱ��H2�ķ�Ӧ����Ϊ$\frac{0.6mol/L}{5min}$=0.12 mol/��L•min����
�ʴ�Ϊ��0.12 mol/��L•min����
��3����ͬʱ����HI�����������С��˵����Ӧ���ʼ�����ƽ��ʱHI���������������Iʱ���ʸı�����ƽ�������ƶ�������ѹǿ��������Ӱ��ƽ���ƶ��������ǽ����¶ȣ�
�ʴ�Ϊ�������¶ȣ�
��4�������¶�ƽ��ʱ�����ƶ���˵������ӦΪ���ȷ�Ӧ������H��0��
�ʴ�Ϊ������
��5��������I�´ﵽƽ���HI��Ũ��Ϊ1.2mol/L����7minʱ���������ѹ��Ϊԭ����һ�룬ѹǿ����ƽ�ⲻ�ƶ���HI��Ũ�ȱ�Ϊԭƽ���2������HIŨ�ȱ�Ϊ2.4mol/L��c��HI����ʱ��仯������Ϊ��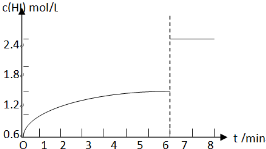 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧƽ�������Ӱ�����ء���Ӧ���ʼ��㡢ƽ�ⳣ���ȣ�ע��ӣ�3���з�Ӧ������ƽ���ƶ��жϸı�����������ȷ����4�����ʱ䣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����кͷ�Ӧ����ѧ��ѧһ����Ҫ�ķ�Ӧ��ijѧ��ʵ��С��Կα��е���������к�ʵ��������о���
����кͷ�Ӧ����ѧ��ѧһ����Ҫ�ķ�Ӧ��ijѧ��ʵ��С��Կα��е���������к�ʵ��������о���| ʵ����� | ��ʼ�ζ��ܶ��� | �յ�ζ��ܶ��� |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ʵ�� �����Һ | A | B | C | D | E | F |
| 4mol/L H2SO4��mL�� | 30 | V1 | V2 | V3 | V4 | V5 |
| ����CuSO4��Һ��mL�� | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O��mL�� | V7 | V8 | V9 | V10 | 10 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �μӵ���Һ | ��ˮ | ��ˮ |
| �����Ļ�ѧʽ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
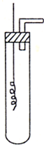 ijѧϰС��Ϊ֤�����۲�ͭ��ϡHNO3��Ӧ�IJ�����NO�����������ͼ��ʾ��ʵ��װ�ã�����������ǵ�˼·��ѡ������ҩƷ���ʵ�飬��дʵ�鲽�貢�ش����⣮��ѡ���ҩƷ��ͭ˿��ϡ���ᡢ�ռ���Һ�����ۡ�CaCO3������
ijѧϰС��Ϊ֤�����۲�ͭ��ϡHNO3��Ӧ�IJ�����NO�����������ͼ��ʾ��ʵ��װ�ã�����������ǵ�˼·��ѡ������ҩƷ���ʵ�飬��дʵ�鲽�貢�ش����⣮��ѡ���ҩƷ��ͭ˿��ϡ���ᡢ�ռ���Һ�����ۡ�CaCO3�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
��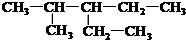 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0 mol | B�� | 2.0 mol | C�� | 3.0 mol | D�� | 4.0 mol |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com