


科目:高中化学 来源: 题型:
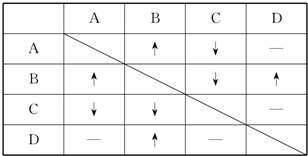
| A、K+、NO3ˉ、Fe2+、Clˉ |
| B、SO42-、Mg2+、Clˉ、Na+ |
| C、SO42-、Na+、Mg2+、CH3COOˉ |
| D、Clˉ、SCNˉ、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯和乙苯 | B、乙烯和丙烯 |
| C、乙烷和乙烯 | D、乙烯和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、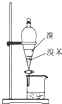 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、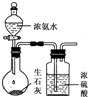 用图制取干燥的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S2Cl2分子中各原子均达到8电子稳定结构 |
| B、制备S2Cl2的反应是化合反应,不是氧化还原反应 |
| C、S2Cl2遇水反应的化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl |
| D、S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol?L-1?min-1 |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为40% |
| D、实验④中,达到平衡时,b<0.060 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com