
【题目】下列根据实验事实得出的结论错误的是( )
实验事实 | 结论 | |
A. | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
B. | 加热时,铜能与浓硫酸反应 | 浓硫酸有强氧化性 |
C. | 某分散系具有丁达尔效应 | 该分散系是胶体 |
D. | Al(OH)3既能与盐酸反应,也能与NaOH溶液反应 | Al(OH)3是两性氢氧化物 |
A.AB.BC.CD.D
【答案】A
【解析】
A. 溶液中加入BaCl2溶液有白色沉淀生成,该白色沉淀可能是BaCO3、BaSO4、BaSO3、AgCl等,该溶液中可能含有SO42-,也可能含有SO32-、Ag+、CO32-等,故A说法错误;
B. 加热时,发生Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,体现浓硫酸的酸性和强氧化性,故B说法正确;
CuSO4+SO2↑+2H2O,体现浓硫酸的酸性和强氧化性,故B说法正确;
C. 丁达尔效应是胶体具有的性质,可以鉴别胶体和溶液,故B说法正确;
D. 氢氧化铝与盐酸反应:Al((OH)3+3HCl=AlCl3+3H2O,氢氧化铝与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O,它们都生成盐和水,即氢氧化铝表现两性,故D说法正确;
答案:A。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】化学反应速率与限度与生产、生活密切相关
(1)A学生为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 688 | 810 | 860 |
①反应速率最大的时间段是____________(填0~1、1~2、2~3、3~4、4~5)min,原因是____________。
②在2~3min时间段以盐酸的浓度变化来表示的反应速率为____________。(设溶液体积不变)
(2)B学生也做同样的实验,但由于反应太快,测不准氢气体积,故想办法降低反应速率,请你帮他选择在盐酸中加入下列____________以减慢反应速率。(填写代号)
A.冰块B.HNO3溶液C.CuSO4溶液
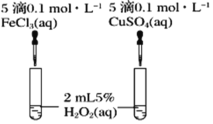
(3)C同学为了探究Fe3+和Cu2+对H2O2分解的催化效果,设计了如图所示的实验。可通过观察___________________________现象,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如图:
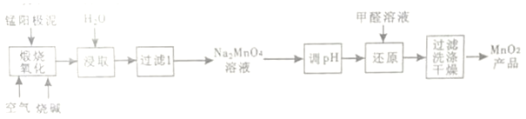
(1)“煅烧氧化”时,1molMnO煅烧完全转化为Na2MnO4失去电子___mol;
(2)为提高Na2MnO4的浸取速率,可采取的措施有___(列举2点)
(3)“调pH”是将溶液pH调至约为10,写出用pH试纸测定溶液pH的操作_____。
(4)MnO2煅烧反应的化学方程式为_____。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1.准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2.然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是___;产品中MnO2的质量分数为ω(MnO2)=___(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
B. 在恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后升高温度可提高N2转化率
2NH3(g)△H<0,达到平衡后升高温度可提高N2转化率
C. 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s)△H>0,当容器中气体压强不变时,该反应达到平衡状态
Z(g)+W(s)△H>0,当容器中气体压强不变时,该反应达到平衡状态
D. 对于可逆反应A(g)![]() B(g)+C(g),增大压强,正反应速率和逆反应速率都增大,并且正反应速率增大的程度大于逆反应速率增大的程度
B(g)+C(g),增大压强,正反应速率和逆反应速率都增大,并且正反应速率增大的程度大于逆反应速率增大的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X(g)+2Y(g)![]() Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
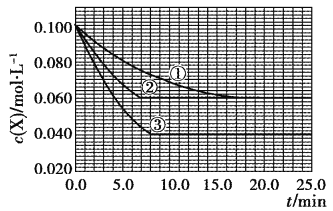
A. 实验②的温度高于实验①的温度
B. 实验②平衡时Y的转化率为60%
C. 实验③与实验①相比,实验③使用了催化剂
D. 反应X(g)+2Y(g)![]() Z(g)的△H>0
Z(g)的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的五种短周期元素X、Y、Z、M、W,其中X是在周期表中原子半径最小的元素,Z 的最外层电子数是内层的3倍,Y、Z左右相邻,Z、W位于同主族,M与W同周期,且与X同主族。
(1)M元素是_______(填元素符号)。
(2)Z、W形成的气态氢化物中,较稳定的是_______(填化学式)。
(3)写出M2Z2的电子式:_______。
(4)由X、Y、Z、W四种元素中的三种组成的一种强酸,其稀溶液能与铜反应,离子方程式为_______。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知:
①1molA能与足量NaOH热的浓溶液反应生成标准状况下44.8L气体;
②A能与盐酸反应产生气体B,该气体能使品红溶液退色。
写出①中反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2Cu+Ag2O=Cu2O+2Ag可设计成如图所示的原电池。普通水泥在固化过程中其自由水分子减少并形成碱性溶液,根据这一物理化学特点,科学家利用该电池发明了电动势法测水泥的初凝时间。下列有关说法正确的是( )
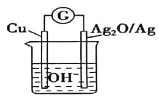
A.电子流动方向从Cu→Ag2O→电解质溶液→Cu,形成闭合回路
B.正极的电极反应式为Ag2O+2H++2e-=2Ag+H2O
C.2molCu与1molAg2O的总能量低于1molCu2O与2molAg的总能量
D.电池工作时,OH-向Cu极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A. 升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B. 0.l0mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 室温下,欲使0.1mol/L醋酸溶液的pH,电离度a都减小,可加入少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
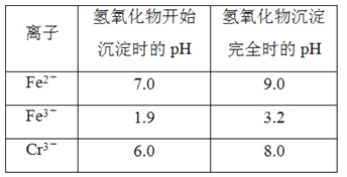
(1)某含铬废水处理的主要流程如图所示:
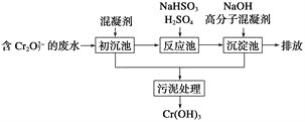
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
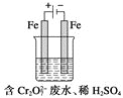
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com