
【题目】反应2SO2(g)+O2(g) ![]() 2SO3(g)在一容积为2L的密闭容器中进行,试回答:
2SO3(g)在一容积为2L的密闭容器中进行,试回答:
(1)若要加快该反应的反应速率,可采取的措施有____________________、___________________。
(2)开始时,SO2的浓度是2mol/L,O2的浓度是4mol/L,2min内,SO2的浓度减少0.8mol/L,则v(SO2)=_____________。在2min末,SO3的浓度是_______________,O2的浓度是_____________。
【答案】加热 增加O2浓度 0.4mol/(L·min) 0.8mol/L 3.6mol/L
【解析】
⑴若要加快该反应的反应速率,可采取的措施有升温、加压、增大二氧化硫的浓度,增大氧气的浓度等,故答案为:加热;增加O2浓度;
⑵开始时,SO2的浓度是2mol/L,O2的浓度是4mol/L,2min内,SO2的浓度减少0.8mol/L,则![]() ,
,
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g)
开始量 2mol/L 4mol/L 0
转化量 0.8mol/L 0.4mol/L 0.8mol/L
2min末 1.2mol/L 3.6mol/L 0.8mol/L
因此2min末,SO3的浓度是0.8mol/L,O2的浓度是3.6mol/L,故答案为:0.4mol/(L·min); 0.8mol/L;3.6mol/L。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】只用一种试剂就可以鉴别乙酸溶液、葡萄糖溶液、淀粉溶液,这种试剂是( )
A. NaOH溶液B. Cu(OH)2悬浊液C. 碘水D. Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂的作用下转化为单质S。已知:
①CO(g)+0.5O2(g)![]() CO2(g) ΔH=-283.0kJ·mol-1
CO2(g) ΔH=-283.0kJ·mol-1
②S(s)+O2(g)![]() SO2(g) ΔH=-296.0kJ·mol-1
SO2(g) ΔH=-296.0kJ·mol-1
则处理CO、SO2的方法的热化学方程式是________________________________。
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。已知:
CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1 (a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
若用标准状况下3.36 L CO将NO2还原至N2(CO完全反应),则整个过程中转移电子的物质的量为______mol,放出的热量为_____(用含有a和b的代数式表示)kJ。
(3)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1 ①
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
2N2(g)+CO2(g)+2H2O(g) ΔH2 ②
若1 mol CH4还原NO2至N2,整个过程中放出的热量为867 kJ,则ΔH2=_______。
(4)已知下列热化学方程式:
①H2(g)+0.5O2(g)![]() H2O(l) △H=-285.8 kJ·mol-1
H2O(l) △H=-285.8 kJ·mol-1
②H2(g)+0.5O2(g)![]() H2O(g) △H=-241.8 kJ·mol-1
H2O(g) △H=-241.8 kJ·mol-1
则H2的燃烧热(△H)为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,则该样品中c(H+)=_____________,该样品放置一段时间后,酸性略有增强,其原因可能是________________________________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种元素A、B、C、D,其中B2-与C+核外电子排布与Ne相同,B原子与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D的元素符号分别为________、_______、________、________。
(2)B2-的电子式为______,C+离子的电子式为______,D原子的结构示意图为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物用途广泛,其中NaCl和HCl是两种重要的含氯化合物。
(1)NaCl的电子式为___,HCl的电子式___。
(2)工业上生产氯气的方法是电解饱和食盐水,写出该反应的化学方程式:___,电解时氯气在___极得到,可用___来检验其存在。
(3)实验室制备氯化氢气体的化学方程式为___。
(4)如图为H2和Cl2燃烧的反应能量变化示意图,请根据此图写出该反应的热化学方程式:___。
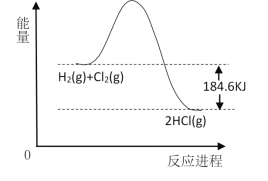
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | k | l | m | ||||||||||||||
(1)画出k元素的原子结构示意图______________________________。
(2)写出j元素的原子核外电子排布式___________________________。
(3)写出l元素的+1价阳离子核外电子排布式___________________________。
(4)写出m元素的原子外围电子排布式___________________________,m元素位于周期表中___________周期_________族_________区。
(5)原子半径大小e___________d,第一电离能大小关系是g___________h,电负性大小关系是c___________d(以上填“>”或 “<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com