
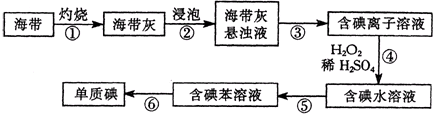


科目:高中化学 来源: 题型:
| 编号 | 叙述 | 离子方程式 | 评价 |
| A | NaHCO3溶液中滴加少量的Ba(OH)2溶液 | Ba2++OH-+HCO3-=BaCO3↓+H2O | 正确 |
| B | 向NaOH溶液中滴加过量Ca(HCO3)2溶液 | OH-+HCO3-+Ca2+=CaCO3↓+H2O | 错误,Ca(HCO3)2溶液中阴阳离子比2:1 |
| C | 足量的Ba(HCO3)2溶液与NaHSO4溶液混合 | H++SO42-+Ba2++HCO3-=BaSO4↓+CO2↑+H2O | 正确 |
| D | 向KHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性 | Ba2++OH-+SO42-+H+=BaSO4↓+H2O | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
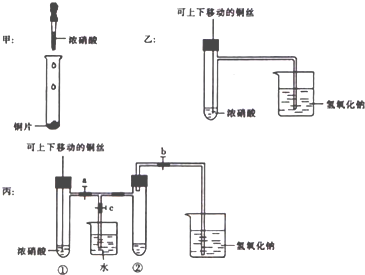
查看答案和解析>>
科目:高中化学 来源: 题型:
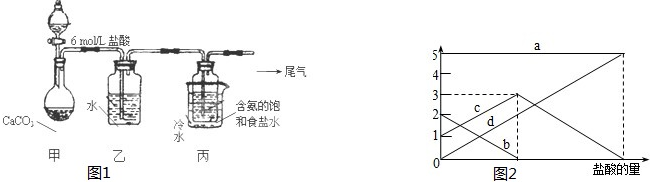
 某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:
某化学课外活动小组从实验室取出硫酸试剂,试剂瓶上标签的部分内容如图所示.该小组欲配制450mL 0.4mol?L-1的稀硫酸溶液:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
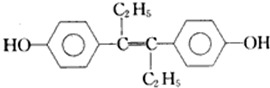
| A、该有机物分子中,最多可能有18个碳原子共平面 |
| B、该分子中有7个碳碳双键,可以与氢气1:7加成 |
| C、该分子对称性好,所以没有顺反异构 |
| D、标况下,1mol该有机物与足量金属钠反应可以放出22.4L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KOH溶液和AlCl3溶液 |
| B、Na2CO3溶液和盐酸 |
| C、NaHCO3溶液和NaOH溶液 |
| D、盐酸和NaAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | X | Y | Z |
| 初始物质的量(mol) | 0.2 | 0.2 | 0 |
| 平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
| A、反应可表示为2X+3Y?2Z,其平衡常数为8000 |
| B、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
| C、若将容器的体积压缩至1L,则X的体积分数减小,浓度增大 |
| D、若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率减小,平衡朝正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com