
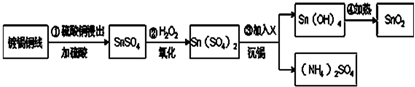
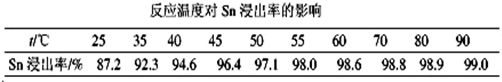
| 4 |
| ||


科目:高中化学 来源: 题型:
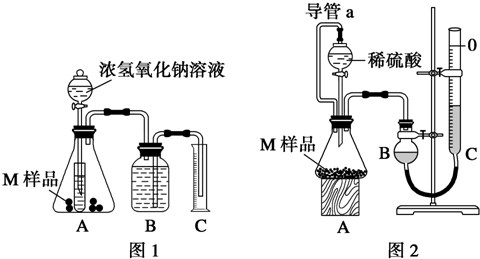
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定性依次减弱 |
| B、NaF、NaCl、NaBr、NaI的熔点依次降低 |
| C、F2、Cl2、Br2、I2的熔沸点逐渐升高 |
| D、H2S的熔沸点小于H2O的熔沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
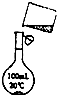 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Na+2H2O=2NaOH+H2↑ |
| B、2F2+2H2O=4HF+O2 |
| C、NaH+H2O=NaOH+H2↑( NaH中H为-1价) |
| D、Cl2+H2O=HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 操作 | 现象 | 结论 |
| 假设一不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、存放W单质的仓库失火不能用CO2灭火 |
| B、Z的氧化物通常形成分子晶体 |
| C、Y的单质能把溴从溴化物中置换出来 |
| D、X的氢化物可以是两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com