
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
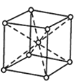
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。
【答案】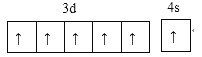 平面三角形 sp2杂化 18NA PCl5
平面三角形 sp2杂化 18NA PCl5 ![]() 体心立方 68
体心立方 68 ![]() a 5a3ρNA×10-22
a 5a3ρNA×10-22
【解析】
A、B、C、D四种元素,原子序数依次增大。A是短周期中原子半径最大的元素为Na元素,B元素3p能级半充满为P元素,C是所在周期电负性最大的元素为Cl元素,D是第四周期未成对电子最多的元素为Cr元素,
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多;
(2)①依据价电子互斥理论确定硝酸根离子的空间构型,再结合杂化轨道理论判断其中心原子的杂化类型;
②结合物质结构判断含有σ键数;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,结构对称的正负电荷重心重合的为非极性分子,结合共价键电子式书写方法解答;
(4)依据金属晶体中金属原子在空间上的堆积模型分析判断;原子的体积占晶胞体积的百分率即空间利用率,结合晶胞结构进行计算;
(5)利用均摊法计算晶胞内原子的个数,再结合晶体的密度 = 晶胞的密度= ![]() 推导出晶体的摩尔质量,其数值即为所求。
推导出晶体的摩尔质量,其数值即为所求。
(1)D元素为铬元素,能层上为半充满状态时价电子为未成对电子最多,其价电子的电子排布图为 ,
,
故答案为: ;
;
(2)①硝酸根离子中价电子对个数=3+![]() (5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
(5+1-3×2)=3,且不含孤对电子,所以该分子为平面三角形,中心原子采用sp2杂化;
故答案为:平面三角形;sp2杂化;
②在 [D(H2O)6] 3+中配合离子Cr3+与水之间形成的化学键为配位键,配位键是特殊的共价键,属于σ键,所以1 mol [D(H2O)6] 3+中含有σ键有12+6 = 18 mol = 18 NA;
故答案为:18 NA;
(3)B、C两种元素分别为P和Cl,形成化合物为:PCl3,PCl5,其中PCl3为三角锥性结构,属于极性分子,PCl5为三角双锥性结构,属于非极性分子,PCl3电子式为:![]() ;
;
故答案为:PCl5;![]() ;
;
(4)由晶胞结构图可知,该金属原子的晶胞堆积模型为体心立方堆积模型,根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a =
+1= 2,设该晶胞的边长为a cm,原子为等径圆球,其半径为r cm,则结合几何构型可知,等径圆球的半径为该晶胞体对角线的1/4,即a = ![]() ,则该晶胞中原子的体积占晶胞体积的百分率为
,则该晶胞中原子的体积占晶胞体积的百分率为![]() =
= ![]() =
= ![]() ×100% =
×100% = ![]() ×3.14×100%
×3.14×100%![]() 68%,
68%,
故答案为:体心立方;68;
(5)E的原子序数比D大3,则E为钴元素,结合E晶体的一种晶胞模型根据均摊法可知晶胞内所含原子数 = 8×![]() +1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 =
+1= 2,则结合几何构型可知,E的原子半径为该晶胞体对角线的1/4 = ![]() a,则该晶胞的质量为
a,则该晶胞的质量为![]() g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
g = ρ g·cm-3×(a×10-7cm) 3,得出M = 5a3ρNA×10-22
故答案为:![]() a;5a3ρNA×10-22。
a;5a3ρNA×10-22。


科目:高中化学 来源: 题型:
【题目】某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如下图:
①该同学所采用的萃取剂可能是______(填序号)。
A. 酒精 B. 苯 C. 四氯化碳 D. 汽油
甲. 加入草取剂后振荡 乙. 静置分层
乙. 静置分层 丙. 分离
丙. 分离
②甲、乙、丙3步实验操作中,不正确的是____________(填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如下关系:
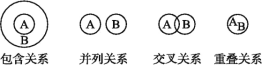
对下列概念的说法正确的是
A. 化合物与纯净物属于重叠关系
B. 分解反应与复分解反应属于并列关系
C. 化合物与金属氧化物属于交叉关系
D. 钠盐与碳酸盐属于并列关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )
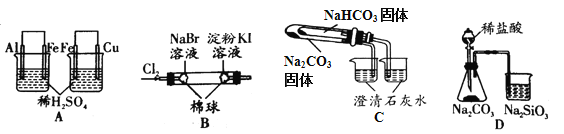
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式______
(3)某同学取步骤③所得溶液于试管中,滴加足量盐酸、BaCl2溶液产生白色沉淀,他认为通过测定产生的白色沉淀的质量即可求出实验所用Na2CS3的量,你是否同意他的观点并说明理由______。
实验2:测定Na2CS3溶液的浓度

按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(4)盛放无水CaCl2的仪器的名称是______,B中发生反应的离子方程式是______。
(5)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是______。
(6)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为______。
(7)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯酚具有微弱的酸性,可利用电场促使C6H5O-定向移动、脱离废水,并富集回收。电渗析装置示意图如下。下列说法不正确的是
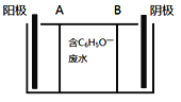
A. 苯酚的电离方程式为:
B. A、B分别为离子交换膜,其中A是阴离子交换膜
C. 电解过程中,阳极室的pH增大
D. 当通过线路中的电子数目为0.1 NA时,有含0.1mol C6H5O-的废水被处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl制备碳酸氢钠。下列实验装置能达到实验目的的是

A. 用装置甲制取氨气 B. 用装置乙制取二氧化碳
C. 用装置丙制取碳酸氢钠 D. 用装置丁分离碳酸氢钠与母液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com