
ÓŅĶ¼Š”ŹŌ¹ÜÄŚĪŖŗģÄ«Ė®£¬¾ßÖ§ŹŌ¹ÜÄŚŹ¢ÓŠpH£½4¾ĆÖƵÄÓźĖ®ŗĶÉśĢśĘ¬”£ŹµŃé¹Ū²ģµ½£ŗæŖŹ¼Ź±µ¼¹ÜÄŚŅŗĆęĻĀ½µ£¬Ņ»¶ĪŹ±¼äŗóµ¼¹ÜÄŚŅŗĆę»ŲÉż£¬ĀŌøßÓŚŠ”ŹŌ¹ÜÄŚŅŗĆę”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ÉśĢśĘ¬ÖŠµÄĢ¼ŹĒŌµē³ŲµÄøŗ¼«£¬·¢Éś»¹Ō·“Ó¦
B£®ÓźĖ®ĖįŠŌ½ĻĒæ£¬ÉśĢśĘ¬Ź¼ÖÕ·¢ÉśĪöĒāøÆŹ“
C£®Ä«Ė®»ŲÉżŹ±£¬Ģ¼µē¼«·“Ó¦Ź½ĪŖO2£«2H2O£«4e£===4OH£
D£®¾ßÖ§ŹŌ¹ÜÖŠČÜŅŗĖįŠŌŌöĒæ
 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éŌÄÓŠ¹Ų׏ĮĻÖŖ£ŗ½šŹōĀĮÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦Źµ¼ŹŹĒ·ÖŅŌĻĀĮ½²½½ųŠŠ£ŗ
µŚŅ»²½£ŗ2Al£«6H2O===2Al(OH)3£«3H2”ü
µŚ¶ž²½£ŗAl(OH)3£«NaOH===Na[Al(OH)4]
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŹéŠ“½šŹōĀĮÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ____________________________”£
(2)ÅŠ¶ĻĮ½²½·“Ó¦µÄ·“Ó¦ĄąŠĶ£ŗµŚŅ»²½Źō________£¬µŚ¶ž²½Źō________(ÓĆĖÄÖÖ»ł±¾·“Ó¦ĄąŠĶ“šĢā)”£
(3)Ēė·ÖĪö£¬½šŹōĀĮÓėĒāŃõ»ÆÄĘČÜŅŗµÄ·“Ó¦ÖŠŃõ»Æ¼ĮŹĒ________£¬»¹Ō¼ĮŹĒ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ¼×”¢ŅŅ”¢±ū”¢XŹĒ4ÖÖ֊ѧ»Æѧ֊³£¼ūµÄĪļÖŹ£¬Ęä×Ŗ»Æ¹ŲĻµ·ūŗĻČēĶ¼£®Ōņ¼×ŗĶX£ØŅŖĒó¼×ŗĶXÄÜ»„»»£©²»æÉÄÜŹĒ[ĢįŹ¾£ŗAl3++3AlO2©+6H2O=4Al£ØOH£©3”ż]£Ø””””£©
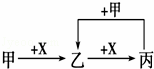
”” A£® CŗĶO2 B£® SO2ŗĶNaOHČÜŅŗ
”” C£® Cl2ŗĶFe D£® AlCl3ČÜŅŗŗĶNaOHČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
X”¢Y”¢Z”¢WŹĒ¶ĢÖÜĘŚµÄ4ÖÖŌŖĖŲ£¬ÓŠ¹ŲĖūĆĒµÄŠÅĻ¢ČēĻĀ±ķĖłŹ¾£®
| ŌŖĖŲ | ²æ·Ö½į¹¹ÖŖŹ¶ | ²æ·ÖŠŌÖŹ |
| X | XµÄµ„ÖŹÓÉĖ«Ō×Ó·Ö×Ó¹¹³É£¬·Ö×ÓÖŠÓŠ14øöµē×Ó | XÓŠ¶ąÖÖŃõ»ÆĪļ£¬ČēXO”¢XO2”¢X2O4µČ£»Ķس£ĒéæöĻĀXO2ÓėX2O4¹²“ę |
| Y | YŌ×ӵēĪĶā²ćµē×ÓŹżµČÓŚ×īĶā²ćµē×ÓŹżµÄŅ»°ė | YÄÜŠĪ³É¶ąÖÖĘųĢ¬Ēā»ÆĪļ |
| Z | ZŌ×ÓµÄ×īĶā²ćµē×ÓŹż¶ąÓŚ4 | ZŌŖĖŲµÄ×īøßÕż»ÆŗĻ¼ŪÓė×īµĶøŗ»ÆŗĻ¼Ū“śŹżŗĶµČÓŚ6 |
| W | WŌ×ÓµÄ×īĶā²ćµē×ÓŹżµČÓŚ2n©3£ØnĪŖŌ×ÓŗĖĶāµē×Ó²ćŹż£© | »Æѧ·“Ó¦ÖŠ£¬WŌ×ÓŅ׏§Č„×īĶā²ćµē×ÓŠĪ³ÉÓėNeŌ×Óµē×Ó²ć½į¹¹ĻąĶ¬µÄWn+ |
ĢīŠ“ĻĀĮŠæÕ°×£ØĢįŹ¾£ŗ²»ÄÜÓĆ×ÖÄøX”¢Y”¢Z”¢W×÷“š£©£ŗ
£Ø1£©XµÄĘųĢ¬Ēā»ÆĪļ·Ö×ӵĽį¹¹Ź½ŹĒ””””£¬ZŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ””””£®
£Ø2£©X”¢Y”¢ZČżŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļĖįŠŌÓÉĒæµ½ČõµÄĖ³ŠņŹĒ””””£®
£Ø3£©³£ĪĀŹ±£¬WµÄĮņĖįŃĪČÜŅŗµÄpH””””7£ØĢī”°=”±”°£¾”±»ņ”°£¼”±£©£®ĄķÓÉŹĒ””””£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£®
£Ø4£©ŹµŃéŹŅÓĆXµÄĒā»ÆĪļµÄĖ®ČÜŅŗÖĘČ”WµÄĒāŃõ»ÆĪļµÄ·½·ØŹĒ””””£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£®
£Ø5£©WÓėŃõ»ÆĢś·“Ó¦µÄ»Æѧ·½³ĢŹ½””””£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŅŃÖŖ£ŗFe(s)£«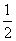 O2(g)===FeO(s)””¦¤H1£½£272 kJ/mol
O2(g)===FeO(s)””¦¤H1£½£272 kJ/mol
2Al(s)£«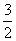 O2(g)===Al2O3(s)””¦¤H2£½£1 675 kJ/mol
O2(g)===Al2O3(s)””¦¤H2£½£1 675 kJ/mol
Ōņ2Al(s)£«3FeO(s)===Al2O3(s)£«3Fe(s)µÄ¦¤HŹĒ
A£®859 kJ/mol B£®£859 kJ/mol C£®£1403 kJ/mol D£®£2491 kJ/mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŌŚ10 LĆܱÕČŻĘ÷ÖŠ£¬1 mol AŗĶ3 mol BŌŚŅ»¶ØĢõ¼žĻĀ·“Ó¦£ŗA(g)£«xB(g)  2C(g)£¬
2C(g)£¬
2 minŗó“ļµ½Ę½ŗā£¬Éś³É0.4 mol C£¬²āµĆ»ģŗĻĘųĢå¹²3.4 mol£¬ŌņĻĀĮŠ½į¹ūÕżČ·µÄŹĒ
A£®Ę½ŗāŹ±£¬ĪļÖŹµÄĮæÖ®±Čn(A)”Ćn(B)”Ćn(C)£½2”Ć11”Ć4
B£®xÖµµČÓŚ3
C£®AµÄ×Ŗ»ÆĀŹĪŖ20%
D£®BµÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0.4 mol/(L”¤min)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
øõĢśæóµÄÖ÷ŅŖ³É·ÖæɱķŹ¾ĪŖFeO·Cr2O3£¬»¹ŗ¬ÓŠMgO”¢Al2O3”¢Fe2O3µČŌÓÖŹ£¬ŅŌĻĀŹĒŅŌøõĢśæóĪŖŌĮĻÖʱøÖŲøõĖį¼Ų£ØK2Cr2O7£©µÄĮ÷³ĢĶ¼£ŗ
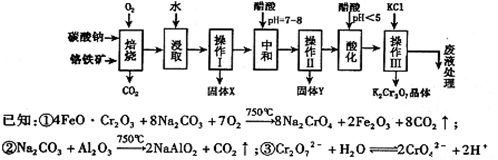
øł¾ŻĢāŅā»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©²Ł×÷¢ńµÄĆū³ĘŹĒ £¬¹ĢĢåXÖŠÖ÷ŅŖŗ¬ÓŠ £ØĢīŠ“»ÆѧŹ½£©£»
£Ø2£©ÓĆ“×Ėįµ÷½ŚČÜŅŗpH=7”«8ŗóŌŁ½ųŠŠ²Ł×÷¢ņĖłµĆ¹ĢĢåYµÄ³É·ÖĪŖ £ØŠ“»ÆѧŹ½£©.
£Ø3£©Ėį»Æ²½ÖčÖŠµ÷½ŚČÜŅŗpH£¼5Ź±·¢Éś·“Ó¦2CrO42££«2H+””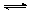 Cr2O72££«H2O.Čō½«½«“×ĖįøÄÓĆŃĪĖį£¬ŃĪĖį»įÓėCr2O72£·“Ó¦Ōģ³É“óĘųĪŪČ¾²¢Éś³ÉCr3+ŌÓÖŹ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ .
Cr2O72££«H2O.Čō½«½«“×ĖįøÄÓĆŃĪĖį£¬ŃĪĖį»įÓėCr2O72£·“Ó¦Ōģ³É“óĘųĪŪČ¾²¢Éś³ÉCr3+ŌÓÖŹ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ .
£Ø4£©ĻĀ±ķŹĒĻą¹ŲĪļÖŹµÄČܽā¶ČŹż¾Ż£¬²Ł×÷III·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ
Na2Cr2O7+2KCl=K2Cr2O7”ż+2NaCl”£øĆ·“Ó¦ŌŚČÜŅŗÖŠÄÜ·¢ÉśµÄĄķÓÉŹĒ£ŗ ”£

£Ø5£©ŗ¬øõ·ĻŌü£Ø·ĻĖ®£©µÄĖęŅāÅŷŶŌČĖĄąÉś“ę»·¾³ÓŠ¼«“óµÄĪ£ŗ¦”£µē½ā·ØŹĒ“¦ĄķøõĪŪČ¾µÄŅ»ÖÖ·½·Ø£¬½šŹōĢś×÷Ńō¼«”¢ŹÆÄ«×÷Ņõ¼«µē½āŗ¬Cr2O72-µÄĖįŠŌ·ĻĖ®£¬Ņ»¶ĪŹ±¼äŗó²śÉśFe(OH)3ŗĶCr(OH)3³Įµķ”£
 ¢Łµē½ā·Ø“¦Ąķ·ĻĖ®µÄ×Ü·“Ó¦ČēĻĀ£¬ÅäĘ½²¢ĢīŠ“æÕȱ£ŗ(ŅŃÖŖ²śĪļÖŠn(Fe(OH)3): n (H2)=1:1)
¢Łµē½ā·Ø“¦Ąķ·ĻĖ®µÄ×Ü·“Ó¦ČēĻĀ£¬ÅäĘ½²¢ĢīŠ“æÕȱ£ŗ(ŅŃÖŖ²śĪļÖŠn(Fe(OH)3): n (H2)=1:1)
___Fe£«___Cr2O72-£«___ £«___H2O £½___Fe(OH)3”ż£«___Cr(OH)3”ż£«___H2”ü£»
¢ŚŅŃÖŖ³£ĪĀĻĀCr(OH)3µÄKsp=6.4”Į10–32mol4/l4£¬Čō¢ńĄąÉś»īŅūÓĆĖ®Ė®ÖŹ±ź×¼øõŗ¬Įæ×īøßĻŽÖµŹĒ0.052 mg/L£¬ŅŖŹ¹ČÜŅŗÖŠc(Cr3+)½µµ½·ūŗĻŅūÓĆĖ®Ė®ÖŹ±ź×¼£¬Šėµ÷½ŚČÜŅŗµÄpH“óÓŚ______”££ØŅŃÖŖlg2=0.3£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ŠæĆĢøɵē³ŲÓÉÓŚĘäÖü“ęŗĶŹ¹ÓĆŹŁĆü½Ļ¶Ģ£¬“ó¶¼ĪŖŅ»“ĪŠŌµē³Ų£¬ÓĆĶźÖ®ŗó±»µ±×÷Ą¬»ųČÓµō”£Õā²»½öĄĖ·ŃĮĖ±¦¹óµÄ½šŹō׏Ō“£¬¶ųĒŅ»¹»į²śÉśŃĻÖŲµÄ»·¾³ĪŪČ¾”£ĻĀ±ķŹĒø÷Ąąµē³ŲµÄ×ŪŗĻ³É·Ö·ÖĪö½į¹ū£ŗ
| ŌŖĖŲ | Šæ | ĆĢ | Ģś | Ķ | Ģ¼ | ĘäĖü |
| ÖŹĮæ°Ł·Öŗ¬Įæ | 13”«27 | 14”«28 | 23”«26 | 0.5”«0.7 | 5”«6 | 13 |
Ķعż¼ņµ„µÄ»śŠµ“¦Ąķ£¬½«µē³ŲÖŠø÷×é·Ö½ųŠŠ×ī“óŌŚĻŽ¶ČµÄ·ÖĄė£¬“Ó¶ųŹ¹Õūøö“¦Ąķ¹ż³ĢµĆµ½¼ņ»Æ”£ŌŁ·Ö±š¶ŌŠæʤŗĶĆĢ·Ū£ØMnO2£©½ųŠŠŹŖ·Ø“¦Ąķ£¬ĶعżŌ¤“¦Ąķ”¢½žČ””¢¾»»ÆµČ¹¤ŠņÖĘ³ö²śĘ·”£¹¤ŅÕĮ÷³ĢČēĻĀĶ¼£ŗ
²éŌÄ׏ĮĻÖŖø÷Ąė×Ó³ĮµķĶźČ«µÄpHĪŖ
| Ąė×Ó | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
ŅŃÖŖ£ŗŠæŌŖĖŲÓėĀĮŌŖĖŲĻąĖĘ£¬¾ßÓŠĮ½ŠŌ”£
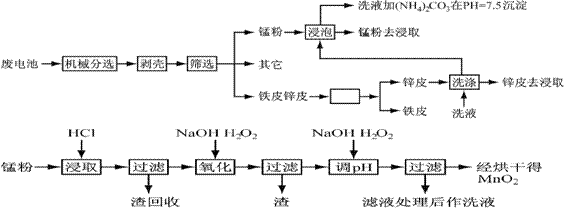
1”¢ŹŠŹŪŠæĆĢøɵē³ŲĪŖ¼īŠŌµē³Ų£¬µē½āÖŹČÜŅŗĪŖKOH,ŌņĘäÕż¼«·“Ó¦ĪŖ £»
µē¼«×Ü·“Ó¦·½³ĢĪŖ £»
2”¢ŌŚŌ¤“¦ĄķÖŠ£¬·ÖĄėĢśĘ¤ŗĶŠæʤµÄ·½·ØŹĒ £¬Ļ“Ņŗ¼Ó(NH4)2CO3ŌŚpH£½7.5³Įµķ³öŅ»ÖÖ¼īŹ½ŃĪ£¬øĆĪļÖŹµÄ»ÆѧŹ½ĪŖ ”£
3”¢¶žŃõ»ÆĆĢÉś²śÖŠ£¬Š“³ö¼ÓČė30%ŃĪĖįČܽāŹ±µÄĄė×Ó·½³ĢŹ½ £»ŃĪĖįČܽāŗó»ŲŹÕµÄŌüŹĒ £»
4”¢ŅŃÖŖµŚ¶ž“Ī¼ÓH2O2ŗóµ÷½ŚpH”Ö9µÄÄæµÄĪŖ½«Mn2+×Ŗ»ÆĪŖMnO2,ŌņµŚŅ»“Ī¼ÓH2O2ŗóµ÷½ŚpH”Ö5£¬ÄæµÄŹĒ £»
5”¢ŹµŃéŹŅÖŠÓĆøßĆĢĖį¼ŲČÜŅŗ¼ģŃéMn2+Ź±£¬²śÉśŗŚÉ«³Įµķ£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ
£»
6”¢ĮņĖįĆĢŌŚøßĪĀĢõ¼žĻĀæÉŅŌµĆµ½ČżÖÖŃõ»ÆĪļ£¬øĆČČ·Ö½āµÄ·½³ĢŹ½ĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¹¤ŅµÉĻÓĆ¼×±½Éś²ś¶ŌōĒ»ł±½¼×ĖįŅŅõ„(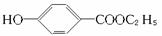 )£¬Ęä¹ż³ĢČēĻĀ£ŗ
)£¬Ęä¹ż³ĢČēĻĀ£ŗ
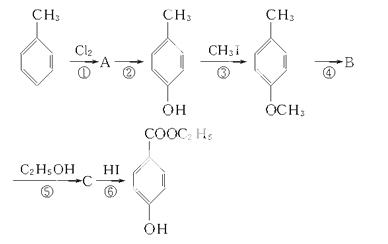
¾ŻŗĻ³ÉĀ·ĻßĢīŠ“ĻĀĮŠæÕ°×£ŗ
(1)ÓŠ»śĪļAµÄ½į¹¹¼ņŹ½£ŗ____________________£¬BµÄ½į¹¹¼ņŹ½£ŗ____________________”£
(2)·“Ó¦¢ÜŹōÓŚ____________·“Ó¦£¬·“Ó¦¢ŻŹōÓŚ______________·“Ó¦”£
(3)¢ŪŗĶ¢ŽµÄÄæµÄŹĒ______________________________________________”£
(4)Š“³ö·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½£ŗ__________________________________________”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com