
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极,e、f是小试管。通电一段时间后,在c、d两极上共收集到336mL(标准状况)气体。
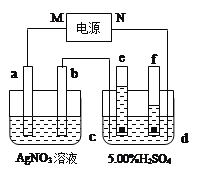
请回答下列问题:
(1)直流电源中,M为_______极。
(2)Pt电极上生成的物质是_______,其质量为______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:__________。
(4)AgNO3溶液的浓度________(填增大、减小或不变。下同),H2SO4溶液的pH_________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为________g。
【答案】 正 Ag 2.16 4∶4∶1∶2 不变 减小 45.18
【解析】(1)右侧装置中盛有5.00%的稀H2SO4,实际上是电解其中的水,阴极产生H2,阳极产生O2,且V(H2):V(O2)=2:1,由e、f中气体体积分析,可确定d极为阴极,则电源的N极为负极,M为正极。
(2)在c、d两极上共收集到336mL(标准状况)气体,根据电解硫酸溶液的反应:2H2O![]() 2H2↑+O2↑得,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol,因为电子转移关系:2H2~O2~4e-,则电路上有0.02mol电子,因此在Pt极(b、阴极)产生Ag,质量为:0.02mol×108gmol-1=2.16g。
2H2↑+O2↑得,V(H2)=336mL×2/3=224mL,即为0.01mol,V(O2)=336mL×1/3=112mL,即为0.005mol,因为电子转移关系:2H2~O2~4e-,则电路上有0.02mol电子,因此在Pt极(b、阴极)产生Ag,质量为:0.02mol×108gmol-1=2.16g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为,n(e-):n(Ag):n(O2):n(H2)=0.02:0.02:0.005:0.01=4:4:1:2。
(4)左侧装置为由Ag(阳极)电极、Pt(阴极)电极和AgNO3溶液组成的电镀池,因此AgNO3溶液浓度不变;电解5.00%的H2SO4溶液,由于其中的水发生电解,因此H2SO4溶液浓度增大,pH减小。
(5)根据前面的计算,电解生成H20.01mol,由2H2O![]() 2H2↑+O2↑得,电解消耗水0.01mol×18gmol-1=0.18g,设原5.00%的H2SO4溶液为xg,则:5.00%x=5.02%(x-0.18),解得:x=45.18g。
2H2↑+O2↑得,电解消耗水0.01mol×18gmol-1=0.18g,设原5.00%的H2SO4溶液为xg,则:5.00%x=5.02%(x-0.18),解得:x=45.18g。


科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
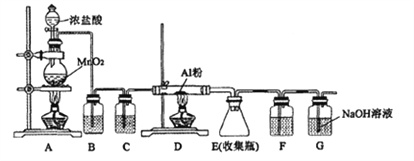
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
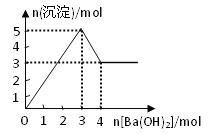
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下相互转化关系,试回答:

(1)写出B的化学式:__________,C中溶质的化学式:__________,D中溶质的化学式:__________,H的化学式:__________。
(2)写出由E转变成F的化学方程式:__________。
(3)写出由A与盐酸反应转变成B的离子方程式:__________。
(4)向G溶液加入A的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给某病人输液,进入病人体内的氯化钠的质量为( )
A.0.9gB.9gC.90gD.18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是( )

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M将电子通过导线流向钢管
C. 在潮湿的酸性士壤中H+向金属棒M移动,抑制H+与铁的反应
D. 该方法称为牺牲阳极的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)![]() 2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023 mol-1,下列叙述中正确的是( )
A. 常温常压下,20.0 g重水(D2O)所含的中子数约为6.02×1023
B. 室温下,42.0 g乙烯和丙烯的混合气体中含有的碳原子数约为3×6.02×1023
C. 通常状况下,1 mol的NO2与N2O4混合气体变为标准状况时其分子数约为6.02×1023
D. 常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com