
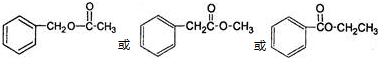
 .(任写一种)
.(任写一种)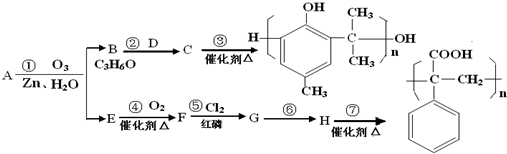
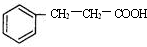 .
. .
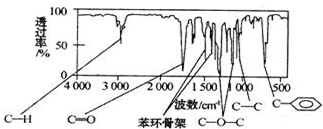
. 分析 化合物A中含C:72.0%、H:6.67%(均为质量分数),其余为氧.A的相对分子质量为150,所以有机物A中C原子个数N(C)=$\frac{72%×150}{12}$=9,H原子个数N(H)=$\frac{6.67%×150}{1}$=10,O原子个数N(O)=$\frac{(1-72%-6.67%)×150}{16}$=2,所以有机物A的分子式为C9H10O2,A分子中只含一个苯环,且苯环上只有一个取代基,A能发生水解反应,说明有酯基,测出A的核磁共振氢谱有5个峰,峰面积之比为1:2:2:2:3,则A的结构简式为 ,据此答题.
,据此答题.
解答 解:化合物A中含C:72.0%、H:6.67%(均为质量分数),其余为氧.A的相对分子质量为150,所以有机物A中C原子个数N(C)=$\frac{72%×150}{12}$=9,H原子个数N(H)=$\frac{6.67%×150}{1}$=10,O原子个数N(O)=$\frac{(1-72%-6.67%)×150}{16}$=2,所以有机物A的分子式为C9H10O2,A分子中只含一个苯环,且苯环上只有一个取代基,A能发生水解反应,说明有酯基,测出A的核磁共振氢谱有5个峰,峰面积之比为1:2:2:2:3,则A的结构简式为 ,
,
(1)根据上面的分析可知,A的分子式为C9H10O2,故答案为:C9H10O2;
(2)根据上面的分析可知,A的结构简式为 ,
,
故答案为: ;
;
(3)①A的芳香类同分异构体中,分子中不含甲基的芳香酸 为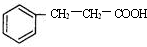 ,
,
故答案为: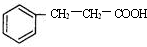 ;
;
②A的芳香类同分异构体中,遇FeCl3显紫色,即有酚羟基,且苯环上只有两个取代基的芳香醛的结构为, ,
,
故答案为: .
.
点评 本题考查有机物分子式的确定、同分异构体的书写等,题目难度中等,本题易错点为(3),注意有条件的同分异构体的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 其单质都能与水反应,通式为X2+H2O═HX+HXO | |
| B. | HX易溶于水,其水溶液都是强酸 | |
| C. | 其单质都有颜色,都有毒 | |
| D. | 最高价含氧酸的通式为HXO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖能发生酯化反应 | |
| B. | 葡萄糖具有还原性 | |
| C. | 葡萄糖充分燃烧的产物为CO2与H2O | |
| D. | 完全燃烧等质量的葡萄糖和甲醛,所需氧气物质的量不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
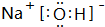 ; 属离子化合物(填“离子”或“共价”).
; 属离子化合物(填“离子”或“共价”). 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
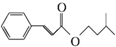 )是一种香料,一种合成路线如图:
)是一种香料,一种合成路线如图: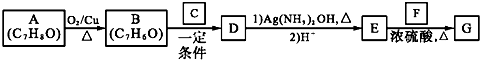
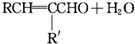
 +CH3CHO$\stackrel{一定条件}{→}$
+CH3CHO$\stackrel{一定条件}{→}$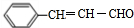 +H2O.
+H2O.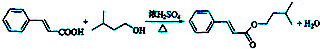 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com