
| A. | 上述三个反应都有单质生成.都属于置换反应 | |
| B. | 氧化性KClO>Br,还原性Br->CI- | |
| C. | 反应②中还原剂与氧化剂的物质的量之比为6:1 | |
| D. | ③中2mol还原剂反应则氧化剂得到电子的物质的量为2mol |
分析 A.置换反应中不仅有单质生成还必须有单质参加;
B.根据同一化学反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性;
C.根据氯气和转移电子之间的关系式计算;
D.根据元素化合价变化计算.
解答 解:A、.根据置换反应的概念分析,反应②中生成物有单质生成但反应物没有单质参加,不是置换反应,故A错误;
B.反应①中氧化剂是氯气,氧化产物是溴,所以氯气的氧化性大于溴,反应②中氧化剂是氯酸钾,氧化产物是氯气,氯酸钾的氧化性大于氯气,反应③中氧化剂是溴酸钾,氧化产物是氯酸钾,所以溴酸钾的氧化性大于氯酸钾,总之,氧化性强弱顺序是 KBrO3>KClO3>Cl2>Br2,单质的氧化性越强,其阴离子的还原性越弱,所以还原性:还原性Br->Cl-,故B正确;
C.反应②KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂是氯酸钾,还原剂是参加反应氯化氢的5/6,所以还原剂和氧化剂的物质的量之比是5:1,故C错误;
D.反应③中还原剂是氯气,氧化剂是溴酸钾,该反应式中2mol还原剂反应则氧化剂得到电子的物质的量20mol,故D错误.
故选B.
点评 本题考查了氧化还原反应,明确元素化合价是解本题的关键,易错选项是C,注意该选项中不是所有氯化氢都参加氧化还原反应,为易错点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | SiH4、PH3、H2S、HCl | B. | HF、HCl、HBr、HI | ||
| C. | H2Se、H2S、HCl、HF | D. | NH3、PH3、AsH3、HF |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
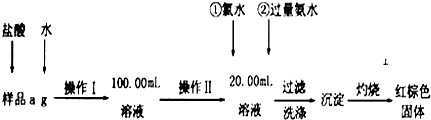
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
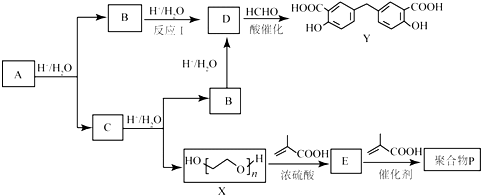
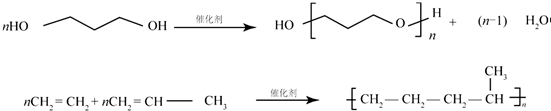
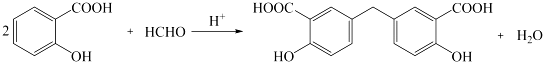 .
.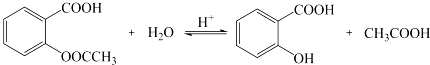 .
.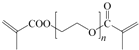 .
.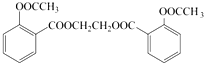 .
.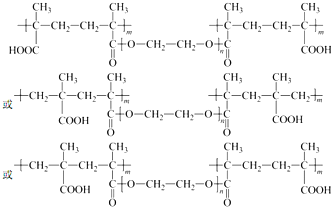 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸:6Br-+8H++2NO${\;}_{3}^{-}$═3Br2+2NO↑+4H2O | |
| B. | 往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3:NH4++Al3++SO42-+Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+BaSO4+H2O | |
| C. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
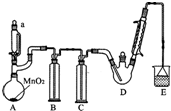 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
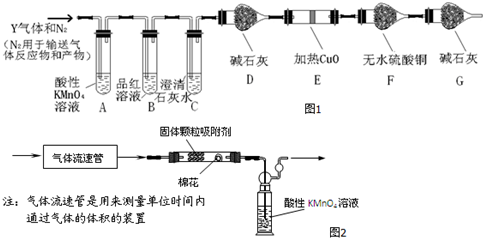
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 126C和146C是一种核素 | |
| B. | 红磷和白磷互为同素异形体 | |
| C. | CH3COOCH2CH3和CH3CH2COOCH3是不同物质 | |
| D. | CH3CH2OH可看成是由-C2H5和-OH两种基团组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
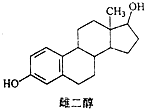
| A. | 能与Na、Na0H溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeC13溶液发生显色反应,但不能发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com