
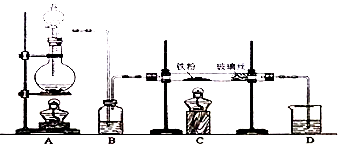
分析 装置A是制备氯气的发生装置,生成的氯气中含氯化氢和水蒸气,通过装置B中浓硫酸干燥氯气,通过装置C反应生成无水氯化铁,剩余气体通过氢氧化钠溶液吸收,
(1)实验室利用二氧化锰与浓盐酸加热反应制取氯气,氯气有毒需要氢氧化钠溶液吸收;
(2)制取无水氯化亚铁,需要HCl气体;
(3)检验氯化铁常用硫氰化钾溶液.
解答 解:(1)制取无水氯化铁的实验中,A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气有毒不能排放到空气中,需要用氢氧化钠溶液吸收,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;
(2)制取无水氯化亚铁,需要HCl气体,故A装置制取的是HCl,反应方程式为:Fe+2HCl$\frac{\underline{\;\;△\;\;}}{\;}$FeCl2+H2,
故答案为:HCl;
(3)检验氯化铁常用硫氰化钾溶液,
故答案为:KSCN溶液;
点评 本题以氯化铁以及氯化亚铁的制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,题目难度中等.


科目:高中化学 来源: 题型:解答题
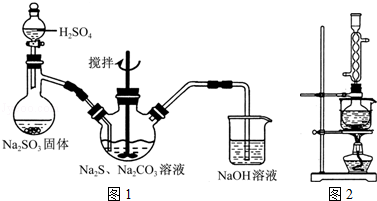
 实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)
实验室也可用如图所示的装置制取少量乙酸乙酯.(已知乙酸乙酯在水中的溶解度较大,15℃时100g水中能溶解8.5g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为△H=-297.23kJ/mol | |
| B. | S(s)→S(g) 吸收热量 | |
| C. | S(g)+O2 (g)═SO2 (g) 放出的热量小于297.23kJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2<2Q3 | B. | Q1+Q2>2Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2>Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
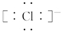 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com