
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,14 g氮气含有的核外电子数为7 NA
B. 标准状况下,2.24 L![]() 与
与![]() 的混合物中含有的分子数为0.1 NA
的混合物中含有的分子数为0.1 NA
C. 常温常压下,7.8 g苯中含有双键的数目为0.3 NA
D. 常温下,1 L 0.1 ![]() 的
的![]() 溶液中氧原子数为0.3 NA
溶液中氧原子数为0.3 NA
科目:高中化学 来源: 题型:
【题目】写出或完成下列热化学方程式。
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ 的热量。写出CH4燃烧的热化学方程式_____。
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 | C-H | C-F | H-F | F-F |
键能kJ/mol | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)1840年瑞士的化学家盖斯(Hess)在总结大量实验事实(热化学实验数据)的基础上提出:“定压或定容条件下的任意化学反应,在不做其它功时,不论是一步完成的还是几步完成的,其热效应总是相同的(反应热的总值相等)。”
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3
请写出CO还原FeO的热化学方程式:_____。
(4)在恒温(500K)、体积为1.0L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 + 3H2![]() 2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
2NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存的是
A.Fe3+、Na+、OH-、Cl-B.Ag+、K+、Cl-、NO3-
C.CO32-、H+、Ca2+、Cl-D.Na+、Cl-、OH-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
H是一种新型香料的主要成分之一,其合成路线如下所示(部分产物和部分反应条件略去):

已知:①RCH=CH2+CH2===CHR′![]() CH2===CH2+RCH===CHR′;
CH2===CH2+RCH===CHR′;
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子。
请回答下列问题:
(1)(CH3)2CCH2的同分异构体中存在顺反异构的有机物的名称为____。
(2)A的核磁共振氢谱除苯环上的H外,还显示____组峰,峰面积比为___。
(3)D分子含有的含氧官能团的名称是___,E的结构简式为____。
(4)CH2===CH2发生加聚反应的化学方程式为____;D和G反应生成H的化学方程式为____。
(5)G的同分异构体中,同时满足下列条件的有____种(不包括立体异构)。
①苯的二取代物 ②与FeCl3溶液发生显色反应 ③含“—COO—”结构
(6)参照上述合成路线,以丙烯为原料(无机试剂任选),设计制备2,3-丁二醇的合成路线。_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是
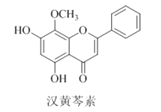
A. 汉黄芩素的分子式为C16H13O5
B. 该物质属于芳香烃
C. 1 mol该物质与溴水反应,最多消耗2 mol Br2
D. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与常用危险化学品的类别不对应的是( )
A.浓H2SO4——腐蚀品B.CH4——易燃液体
C.Na——遇湿易燃物品D.KMnO4——氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填写:
(1) 的名称(系统命名法)是________________________
的名称(系统命名法)是________________________
(2)4—甲基—2—戊烯的结构简式是__________________________
(3)相对分子质量为72且沸点最低的烷烃的结构简式是_____________________
(4)合成高聚物![]() 其单体的结构简式是______________________
其单体的结构简式是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,烧杯中盛有200mL1 mol/L的CuSO4溶液。

(1)正极材料为______,电池工作时SO42-向______移动(填Zn或Cu)。
(2)正极电极反应式为_______。
(3)若初始时Zn片与Cu片质量相等,实验结束后,称得两极质量差为12.9g,则反应中转移电子的物质的量为____,反应后溶液中溶质的物质的量浓度为________(忽略溶液体积的变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。

(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:亚磷酸______________________,亚砷酸________________________。
(2)亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式分别是:
亚磷酸:______________________________________,
亚砷酸:_______________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,写出化学方程式_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com