
【题目】2019 年是“国际化学元素周期表年”。 1869 年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法中错误的是
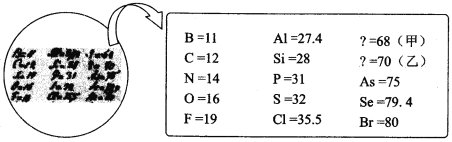
A. 甲位于现行元素周期表第四周期第ⅢA 族B. 原子半径比较:甲>乙> Si
C. 乙的简单气态氢化物的稳定性强于CH4D. 推测乙的单质可以用作半导体材料
【答案】C
【解析】
从示意图可以看出同一行的元素在同一主族,同一列的元素在同一周期,甲元素与B和Al在同一主族,与As同一周期,则甲在元素周期表的位置是第四周期第ⅢA族,为Ga元素,同理,乙元素的位置是第四周期第ⅣA族,为Ge元素。
A.从示意图可以看出同一行的元素在同一主族,同一列的元素在同一周期,甲元素与B和Al在同一主族,与As同一周期,则甲在元素周期表的位置是第四周期第ⅢA族,A项正确;
B.甲元素和乙元素同周期,同周期元素核电荷数越小半径越大,甲元素的原子序数小,所以甲元素的半径大于乙元素。同主族元素,核电荷数越大,原子半径越大,乙元素与Si同主族,乙元素核电荷数大,原子半径大,排序为甲>乙>Si,B项正确;
C.同主族元素的非金属性从上到下越来越弱,则气态氢化物的稳定性越来越弱,元素乙的简单气态氢化物的稳定性弱于CH4,C项错误;
D.乙为Ge元素,同主族上一个元素为硅元素,其处于非金属和金属元素的交界处,可用作半导体材料,D项正确;
本题答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
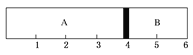
(1)A室混合气体的物质的量为________,标况下体积为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2CrH2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬(溶液呈绿色)还原为二价铬(溶液呈亮蓝色);二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如下,请回答以下问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是___________________,仪器a的名称是___________。
(2)将过量的锌和氧化铬固体置于c中,加入少量蒸馏水,按图连接好,打开K1、K2,关闭K3。此时观察到c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________;过量锌的作用是______________________________________________。
(3)打开K3,关闭K1、K2,观察到现象为___________________________、d中出现砖红色沉淀,为得到纯净的砖红色晶体,需采取的操作是__________、__________、洗涤、干燥。
(4)装置d可能存在的缺点为_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
Prolitane是一种抗抑郁药物,以芳香烃A为原料的合成路线如下:

请回答以下问题:
(1)D的化学名称为___________,D→E的反应类型为___________。
(2)G的官能团名称为___________。
(3)B的结构简式为______________________。
(4)F→G的化学方程式为______________________。
(5)X是D的同系物,ⅹ分子比D分子少一个碳原子,且能发生银镜反应,则满足此条件的X共有___________种(不含立体异构);其屮核磁共振氢谱显示为5组峰,其峰面积比为3︰2︰2︰2︰1,写出符合该要求的Ⅹ的一种同分异构体的结构简式:______________________。
(6)参照 Prolitane的合成路线,设计一条由苯和乙醇为原料制备苯甲酸乙酯的合成路线(其他无机试剂和溶剂任选)。____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HC1 ②适量的NH4NO3 ③适量的氨水 ④适量的NaOH
A. ①② B. ②③ C. ③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol/L盐酸滴入20.00 mL 1.000 mo1/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )
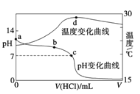
A. a点由水电离出的c(H+) = 1.0 × 10-14 mo1/L
B. b点:c(NH4+) > c(Cl-) > c(OH-) > c(H+)
C. c点:盐酸与氨水恰好完全反应
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①323 K时反应的平衡转化率ɑ =______%。比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要提高SiHCl3平衡转化率,可采取的措施是_______,要缩短反应达到平衡的时间,可采取的措施有_______。(两问均从下列选项中选择合适的选项填空)
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=_____________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中含有NA个氯化氢分子的是( )
A.将1mol H2和lmol Cl2光照或点燃后的产物
B.室温下22.4L的HCl气体
C.室温下,将1mol HCl气体通入100mL水中所得的液体
D.室温下,36.5g HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com