
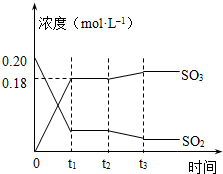
 ��֪2SO2 ��g��+O2��g��?2SO3��g����H=-196kJ?mol-1��5000Cʱ��2mol SO2��1molO2װ��һ����㶨��10L�ܱ������У�2���ӣ�t1��ʱ�ﵽƽ�⣮��ͼ��ʾ��
��֪2SO2 ��g��+O2��g��?2SO3��g����H=-196kJ?mol-1��5000Cʱ��2mol SO2��1molO2װ��һ����㶨��10L�ܱ������У�2���ӣ�t1��ʱ�ﵽƽ�⣮��ͼ��ʾ��| ��c |
| ��t |
| c2(SO3) |
| c2(SO2)?c(O2) |
| 0.09mol/L |
| 2min |
| c2(SO3) |
| c2(SO2)?c(O2) |
| (0.18mol/L)2 |
| (0.02mol/L)2?0.01mol/L |
| (0.2x)2 |
| (0.2-0.2x)2?(0.1-0.1x) |
| (0.2x)2 |
| (0.2-0.2x)2?(0.1-0.1x) |
| w |
| 2 |
| w |
| 2 |
| w |
| 2 |
| 0.2mol |
| 10L |
| 1.8mol |
| 10L |
| 1.1mol |
| 10L |
| 0.182 |
| 0.022?0.11 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������������ᣩ������NaOH��Һ���ȣ���Һ |
| B���������ӣ�����ˮ������ |
| C���������֣����ᣩ������Na2CO3��Һ����Һ |
| D���������ӣ�������NaOH��Һ����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+) |
| c(HF) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��1��ˮ�ĵ���ƽ��������ͼ��ʾ������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���
��1��ˮ�ĵ���ƽ��������ͼ��ʾ������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ����¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
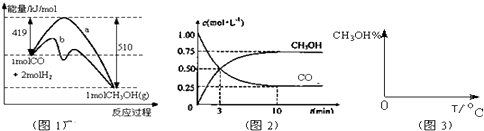
| n(CH3OH) |
| n(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n(CH3OH) |
| n(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| A��9.1% | B��10.0% |
| C��28.6% | D��71.5% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com