
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离的c(H+)=1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- | |
| D. | 含1.0mol•L-1Al3+的溶液中:Na+、HCO3-、SO42-、Mg2+ |
分析 A.硝酸钾在酸性条件下能够氧化亚铁离子;
B.该溶液中存在大量氢离子,四种离子之间不反应,能够大量共存;
C.由水电离的c(H+)=1×10-13mol/L溶液中存在大量氢离子或氢氧根离子,碳酸根离子、偏铝酸根离子与氢离子反应;
D.铝离子与碳酸氢根离子发生双水解反应.
解答 解:A.KNO3、H+、Fe2+之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.c(H+)/c(OH-)=1012的溶液中存在大量氢离子,NH4+、Al3+、NO3-、Cl-之间不发生反应,都不与氢离子反应,在溶液中不能大量共存,故B正确;
C.由水电离的c(H+)=1×10-13mol/L溶液中存在大量氢离子或氢氧根离子,AlO2-、CO32-都与氢离子反应,在酸性溶液中不能大量共存,故C错误;
D.Al3+、HCO3-之间发生双水解反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:解答题
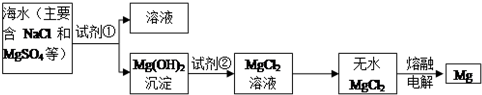
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol | B. | 小于0.6 mol | ||
| C. | 大于0.6 mol | D. | 大于0.3 mol,小于0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳离子只能得电子被还原,阴离子只能失电子被氧化 | |
| B. | 已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ | |
| C. | 化学反应中,得电子越多的氧化剂,其氧化性就越强 | |
| D. | 已知还原性:B->C->D-,反应 2C-+D2═2D-+C2 和反应 2C-+B2═2B-+C2 都能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离常数 | 1.8×10-5 | 2.9×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液①C(CH3COONa) ②C(NaClO) ③C(NaHCO3) ④C(Na2CO3)pH关系为:④>②>③>① | |
| B. | 少量CO2通入次氯酸钠溶液中:CO2+ClO-+H2O═HClO+HCO3- | |
| C. | 新制氯水中Cl2+H2O?HCl+HClO为适当增大HClO 的浓度,可加入少量固体Na2CO3 | |
| D. | 某浓度的NaClO溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
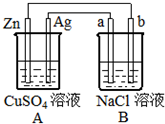 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物(括号内为杂质) | 除杂试剂(填序号) | 反 应 离 子 方 程 式 |
| ①Cu (CuO) | ||
| ②NaBr (NaI) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的比例模型示意图: | B. | 2-甲基-2-戊烯的键线式: | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 1,3-丁二烯的分子式:C4H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com