
某同学欲研究SO2的性质.
(1)将相关的含硫物质分为如表所示3组,则第2组中物质X的化学式是 H2SO3 .
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |
(2)实验室制取SO2的化学方程式为 .
(3)利用下图所示的装置研究SO2的性质:(熔点:SO2﹣76.1℃,SO3 16.8℃,沸点:SO2﹣10℃,SO3 45℃).
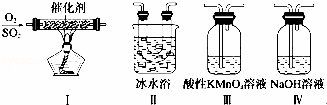
①装置Ⅰ模拟工业生产中SO2催化氧化的反应,其化学方程式是 .
②甲同学按Ⅰ、Ⅱ、III、Ⅳ的顺序连接装置,装置Ⅱ的作用是 ; 装置Ⅲ中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是 .
③乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置,若装置Ⅳ中有40mL 2.5mol•L﹣1 NaOH溶液,反应后增重4.8g,则产物(水除外)的物质的量之比是 .
| 探究二氧化硫与水和品红溶液的反应. | |
| 专题: | 实验设计题. |
| 分析: | (1)将相关的含硫物质依据硫元素化合价分组,第2组物质中硫元素的化合价都是+4价,判断X为+4价的酸为H2SO3 ; (2)实验室一般用亚使硫酸钠与稀硫酸反应制取二氧化硫; (3)①二氧化硫催化氧化产物是三氧化硫; ②冰水浴温度下,三氧化硫呈固体状态,二氧化硫具有还原性,可以被高锰酸钾氧化; ③二氧化硫是酸性氧化物,可以和氢氧化钠反应,根据已知量的关系书写方程式,求解产物(水除外)的物质的量之比. |
| 解答: | 解:(1)将相关的含硫物质依据硫元素化合价分组,依据第2组物质中硫元素的化合价都是+4价,按照氧化物、酸、盐的顺序排列下来,判断X为+4价的酸为H2SO3 ; 故答案为:H2SO3 ; (2)实验室用亚硫酸钠与稀硫酸反应制取二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)═SO2↑+Na2SO4+H2O, 故答案为:Na2SO3+H2SO4(浓)═SO2↑+Na2SO4+H2O; (3)①二氧化硫催化氧化产物是三氧化硫,即2SO2+O2 ②在冰水浴温度下,三氧化硫呈固体状态,所以装置Ⅱ的作用是使SO3凝结成固体与SO2分离,二氧化硫具有还原性,可以被高锰酸钾氧化,发生的反应为:5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+, 故答案为:使SO3凝结成固体与SO2分离;5SO2+2MnO4﹣+2H2O=5SO42﹣+2Mn2++4H+; ③二氧化硫是酸性氧化物,可以和氢氧化钠反应,二氧化硫物质的量和氢氧化钠物质的量进行分析判断生成产物,若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH=Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH=NaHSO3;装置IV中有40mL 2.5mol•L﹣1NaOH溶液中n(NaOH)=0.1mol,n(SO2)= 故答案为:1:2. |
| 点评: | 本题考查了物质分类方法,规律总结,实验过程分析判断,化学方程式和离子方程式的书写,反应产物的分析判断,题目难度中等,注意(3)③量不同产物不同. |


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
实验室常用邻苯二甲酸氢钾(KHC8H4O4)来测定氢氧化钠溶液的浓度,反应如下:KHC8H4O4+NaOH====KNaC8H4O4+H2O。邻苯二甲酸氢钾溶液呈酸性,滴定到达终点时,溶液的pH约为9.1。
(1)为测定N aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
aOH溶液的浓度,准确称取一定质量的邻苯二甲酸氢钾(KHC8H4O4)加入到250 mL锥形瓶中,加入适量蒸馏水溶解,应选用__________作指示剂,到达终点时溶液由__________色变为__________色,且半分钟不褪色。(提示:指示剂变色范围与滴定终点pH越接近误差越小)
(2)在测定NaOH溶液浓度时,有下列操作:①向溶液中加入1滴~2滴指示剂; ②向锥形瓶中加20 mL~30 mL蒸馏水溶解; ③用NaOH溶液滴定到终点,半分钟不褪色;④重复以上操作; ⑤准确称量0.400 0 g~0.600 0 g邻苯二甲酸氢钾加入到250 mL锥形瓶中;⑥根据两次实验数据计算NaOH的物质的量浓度。
以上各步操作中,正确的操作顺序是__________。
(3)上述操作中,将邻苯二甲酸氢钾直接放在锥形瓶中溶解,对实验是否有影响?________________________________________。(填“有影响”或“无影响”)
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测定的NaOH溶液滴定,此操作使实验结果__________。(填“偏大”“偏小”或“无影响”)
(5)现准确称取KHC8H4O4(相对分子质量为204.2)晶体两份质量均为0.510 5 g,分别溶于水后加入指示剂,用NaOH溶液滴定至终点,消耗NaOH溶液体积平均为20.00 mL,则NaOH溶液的物质的量浓度是多少?(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列叙述中错误的是( )
|
| A. | 1mol Al3+含有的核外电子数为10NA |
|
| B. | 1mol Na与足量O2反应,无论生成Na2O或Na2O2均失去NA个电子 |
|
| C. | 标准状况下,2.24L乙醇中所含分子数约为0.1NA |
|
| D. | 1L 0.1mol/L的盐酸中,含0.1NA个Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
证明某溶液中只含Fe2+而不含有Fe3+的实验方法是( )
|
| A. | 先加氯水,再滴加KSCN溶液后显红色 |
|
| B. | 先滴加KSCN溶液,不显红色,再滴加氯水后显血红色 |
|
| C. | 滴加NaOH溶液,产生红褐色沉淀 |
|
| D. | 只需要滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
鉴别少量乙烯与乙炔气体的实验方法是( )
|
| A. | 通入溴水中,观察溴水的消耗量 |
|
| B. | 通入酸性KMnO4溶液中,观察溶液是否褪色 |
|
| C. | 点燃后观察燃烧现象 |
|
| D. | 闻气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,此有机物的相对分子质量为( )
|
| A. | 78 | B. | 79 | C. | 80 | D. | 81 |
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/10-12m | 160 | 110 | 70 | 66 |
| 主要化合价 | +2 | +5、+3、-3 | +5、+3、-3 | -2 |
下列叙述正确的是(双选)( )
A.离子半径:W<X
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com