
【题目】H2SO3是二元弱酸,NaHSO3溶液呈酸性,在0.1 mol·L-1 NaHSO3溶液中,下列关系正确的是
A.![]()
B.![]()
C.![]()
D.![]()
【答案】AB
【解析】
HSO3-在水溶液中即可以电离也可以水解,HSO3-H++SO32-,HSO3-+H2OH2SO3+OH,NaHSO3溶液显酸性,说明HSO3-电离程度大于水解程度。
A、NaHSO3溶液显酸性,说明HSO3-电离程度大于水解程度,,说明电离生成SO32-的浓度大于水解生成H2SO3的浓度,水解和电离都是微弱的,则HSO3-浓度最大,有c(HSO3—)>c(SO32—)>c(H2SO3),A正确;
B、NaHSO3溶液中,根据物料守恒,c(Na+)=c(HSO3—)+c(SO32—)+c(H2SO3),B正确;
C、由于发生水解,有c(Na+)>c(HSO3—),C错误;
D、根据电荷守恒,有c(Na+)+c(H+)=c(HSO3—)+c(OH-)+2c(SO32—),D错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、 m、n分别是元素W、X、Y、Z的气体单质,p和 s均为有色气体,v的水溶液呈碱性。常温下,0.1 mol L -1t 溶液与 0.1 mol L -1 u 溶液的pH均为1。下列说法不正确的是

A.Y、W的最高价氧化物对应的水化物均为强酸
B.Z和Y的简单氢化物的稳定性和沸点高低均为:Z>Y
C.s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D.v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物广泛的存在于我们的生活中。
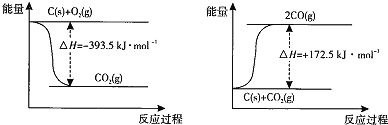
(1)根据下列反应的能量变化示意图,![]() ______ 。
______ 。
(2)在体积为2L的密闭容器中,充入1mol ![]() 和3mol H,一定条件下发生反应:
和3mol H,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的物质的量随时间变化的曲线如图所示:
的物质的量随时间变化的曲线如图所示:

①从反应开始到平衡,![]() 的平均反应速率
的平均反应速率![]() ______ 。
______ 。
②下列措施中能使化学平衡向正反应方向移动的是 ______ ![]() 填编号
填编号![]() 。
。
A.升高温度
![]() 将
将![]() 及时液化移出
及时液化移出
C.选择高效催化剂
![]() 再充入1mol
再充入1mol ![]() 和4mol
和4mol ![]()
(3)![]() 溶于水生成碳酸。已知下列数据:
溶于水生成碳酸。已知下列数据:
弱电解质 |
|
|
电离平衡常数 |
|
|
现有常温下![]() 的
的![]() 溶液,已知:
溶液,已知:![]() 水解的平衡常数
水解的平衡常数![]() ,
,![]() 第一步水解的平衡常数
第一步水解的平衡常数![]() 。
。
①判断该溶液呈 ______ ![]() 填“酸”、“中”、“碱”
填“酸”、“中”、“碱”![]() 性,写出该溶液中
性,写出该溶液中![]() 发生第一步水解的离子方程式 ______ 。
发生第一步水解的离子方程式 ______ 。
②下列粒子之间的关系式,其中正确的是 ______ 。
A.![]()
B.![]()
C.![]()
D.![]()
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和![]() 为原料做成电池。原理如图所示:
为原料做成电池。原理如图所示:
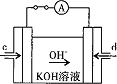
通入CO的管口是 ______ ![]() 填“c”或“d”
填“c”或“d”![]() ,写出该电极的电极反应式: ______ 。
,写出该电极的电极反应式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y原子的最外层电子数是电子层数的2倍,Z是地壳中含量最高的非金属元素,Q元素形成的单质是重要的半导体材料,R元素原子核外的M电子层电子数比L层少2个。请回答下列问题:
(1)画出Z的原子结构示意图__________,其氢化物的电子式__________。
(2)![]() 、Z、Q三种元素的原子半径由大到小的顺序__________
、Z、Q三种元素的原子半径由大到小的顺序__________![]() 用元素符号表示
用元素符号表示![]() 。
。
(3)![]() 元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________
元素在周期表中的位置_________,与Q同主族第四周期的元素的原子序数是_____,在周期表的以下区域中,可以找到类似的半导体材料的是__________![]() 填字母序号
填字母序号![]() 。
。
![]() 过渡元素区域
过渡元素区域
![]() 金属和非金属元素的分界线附近
金属和非金属元素的分界线附近
![]() 含有氟、氯、硫、磷等元素的区域
含有氟、氯、硫、磷等元素的区域
![]() 下列能说明Y与R元素非金属性相对强弱的是__________。
下列能说明Y与R元素非金属性相对强弱的是__________。
![]() 单质与氢气化合的难易程度
单质与氢气化合的难易程度
![]() 含氧酸的酸性:
含氧酸的酸性:![]()
![]() 与R相互形成的化合物中元素的化合价
与R相互形成的化合物中元素的化合价
Ⅱ![]() 已知:
已知:

合成氨的热化学方程式是___________________________________。
Ⅲ![]() 有人设想以
有人设想以![]() 和
和![]() 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。正极的电极方程式为_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门实用性很强的科学,与社会、环境等密切相关。下列说法错误的是
A.用![]() 合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
B.用含橙色酸性重铬酸钾的仪器检验酒驾,利用了乙醇的挥发性和还原性
C.浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水存在如下电离:H2O![]() H++OH- H>0,下列叙述正确的是
H++OH- H>0,下列叙述正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体NH4Cl,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )

A. 曲线①代表的粒子是HC2O4-
B. 0.1 molL-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4)
C. pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-)
D. 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种重要的精细化工产品,被广泛用于制药、染料、农药及日用化工。以下为其中一种合成二甲醚的方法:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5kJ·mol-1
③2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ·mol-1。
(2)某温度下在容积为2L的密闭容器中加入CH3OH(g)发生反应②,测得有关数据如下:
反应时间/min | 0 | 1 | 2 | 3 | 4 |
n(CH3OH)/mol | 1.02 | 0.4 | 0.2 | 0.02 | 0.02 |
①前2min内,H2O(g)的平均反应速率为________mol·L-1·min-1;此反应在该温度下的平衡常数为________;若再向容器中分别加入CH3OH(g)0.02mol、CH3OCH3(g)1.0mol,此时该反应中υ正________υ逆(填“>”、“<”或“=”)。
②根据文献,甲醇的转化率可以根据冷凝的液相中甲醇与水的百分含量来计算(忽略挥发到气相的甲醇),若以A表示冷凝液中水的质量分数,B表示冷凝液中甲醇的质量分数,则甲醇的转化率α(CH3OH)=________。
(3)一定条件下,发生反应③,原料气中![]() 和温度对CO2转化率影响的实验数据如图所示。
和温度对CO2转化率影响的实验数据如图所示。
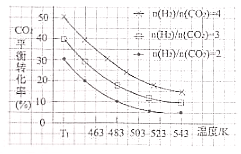
结合图像,可得出CO2平衡转化率受外界条件影响的变化规律为:
a:________;
b:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T0℃时,在2 L的密闭容器中发生反应:X(g)+Y(g)![]() Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
Z(g)(未配平),各物质的物质的量随时间变化的关系如图a所示。其他条件相同,温度分别为T1℃、T2℃时发生反应,X的物质的量随时间变化的关系如图b所示。下列叙述正确的是( )
图a 图b
图b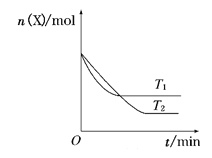
A.该反应的正反应是吸热反应
B.T1℃时,若该反应的平衡常数K =50,则T1<T0
C.图a中反应达到平衡时,Y的转化率为37.5%
D.T0℃,从反应开始到平衡时:v(X)=0.083 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com