
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 9.05g |
| 10g |


科目:高中化学 来源: 题型:
| A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B、化学反应中的能量变化都表现为热量变化 |
| C、△H的大小与热化学方程式的计量数无关 |
| D、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只含一种元素的物质,可能为混合物 | ||
| B、非金属元素都是主族元素,最外层电子数都大于或等于3 | ||
C、
| ||
| D、工业由N2制备氨气以及由NH3氧化制备硝酸的过程都属于氮的固定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、与V L CO具有相同分子数的CO2,其体积一定是V L |
| C、含有相等氧原子数的CO与CO2,其质量之比为28:11 |
| D、含有相等碳原子数的CO与CO2,其密度之比为21:22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
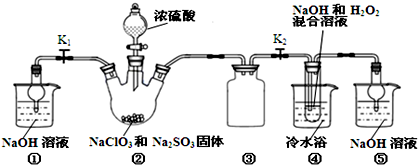
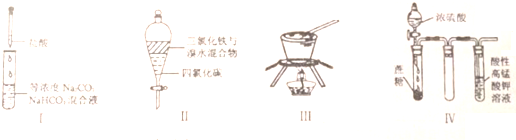 下列由相关图象作出的描述正确的是( )
下列由相关图象作出的描述正确的是( )| A、实验Ⅰ:滴加稀盐酸,NaHCO3先反应立即产生大量气泡 |
| B、实验Ⅱ:振荡后静置分层,上层无色溶液从上口倒出 |
| C、实验Ⅲ:从饱和硫酸钠溶液中提取硫酸钠晶体 |
| D、装置Ⅳ:酸性KMnO4溶液中出现气泡,溶液颜色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
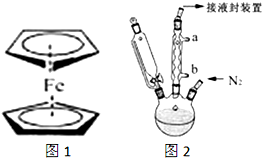 二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O
二茂铁(结构如图1)是一个典型的金属有机化合物,实验室常用氯化亚铁和环戊二烯在碱性条件下反应得到.反应原理为:FeCl2+2C5H6+2KOH→Fe(C5H5)2+2KCl+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:
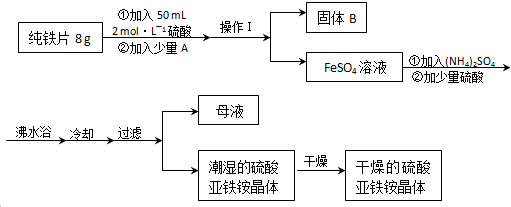
查看答案和解析>>
科目:高中化学 来源: 题型:
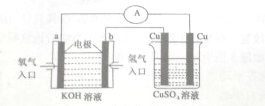 氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:
氢氧燃料电池能量转化率高,具有广阔的发展前景,先用氢氧燃料电池进行如图所示实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com